
下载APP

【简答题】


电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。 化学式 电离平衡常数(25℃) NH3·H2O Kb=1.77×10-5 HCN Ka=4.93×10-10 CH3COOH Ka=1.76×10-5 H2CO3 Ka1=4.30×10-7,Ka2=5.61×10-11 (1)25℃时,pH=11的NaCN溶液中水电离出的c(OH -)____________mol/L。 (2)25℃时,有等浓度的NaCN溶液、Na 2CO 3溶液、CH 3COONa溶液,三种溶液的pH由大到小的顺序为________。 (3)NH 4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH 4HCO 3溶液呈_______性,0.1mol/LNH 4HCO 3溶液中物质的量浓度最大的离子是_________(填化学式)。 (4)25℃时,等浓度的CH 3COOH溶液和CH 3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。 (5)向NaCN溶液中通入少量CO 2,所发生反应的化学方程式______________。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(g)+O 2 (g )═CO 2 (g),△H 1 ; C(g)+ 1 2 O 2 (g)═CO(g ),△H 2 ; ②S(s)+O 2 (g )═SO 2 (g),△H 3 ; S(g)+O 2 (g)═SO 2 (g),△H 4 ; ③H 2 (g)+ 1 2 O 2 (g )═H 2 O(l),△...
A.
①②③
B.
②③④
C.
④
D.
①
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量
【单选题】已知 Fe 3+ + e = Fe 2+ 的标准电极电势为 0.770V ,在 101.325KPa 和 298.15K 时,测得 Fe 3+ /Fe 2+ 电对的电极电势 0.750V ,则该电极溶液中离子浓度是多少?
A.
c (Fe 3+ ) < 1 mol·dm -3
B.
c (Fe 3+ ) > 1 mol·dm -3
C.
c (Fe 3+ )/( Fe 2+ ) < 1
D.
c (Fe 3+ )/(Fe 2+ ) > 1
【单选题】反应: 在298K时各离子浓度均为0.10 mol·L -1 时自发向右进行。下列叙述中正确的是()。
A.
E ;
B.
;
C.
E=0.10E ;
D.
E >0,但E<0。
【单选题】如果 HgCl 2 的 K SP = 4 ́ 10 -15 , 则 HgCl 2 的饱和溶液中 Cl - 离子浓度 (mol·dm -3 ) 是
A.
8 ´ 10 -15
B.
2 ´ 10 -15
C.
1 ´ 10 -5
D.
2 ´ 10 -5
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
A.
-2878kJ/mol
B.
-2658kJ/mol
C.
-1746kJ/mol
D.
-1526kJ/mol
相关题目:

【单选题】区分强弱电解质的依据是[ ]
A.
化合物水溶液的导电能力
B.
化合物在水中的溶解度
C.
化合物在水中的电离程度
D.
化合物在常温下是不是气体
【单选题】循环水中计算浓缩倍率,一般以水中的()离子浓度来计算。
A.
Ca2+;
B.
HCO3-;
C.
Cl-;
D.
SO42-。
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量
【单选题】下列电对中,有关离子浓度增大时,电极电势减小的是
A.
Fe 2+ / Fe
B.
Sn 2+ / Sn
C.
Cl 2 /Cl -
D.
H + / H 2
【单选题】已知 Fe 3+ + e = Fe 2+ 的标准电极电势为 0.770V ,在 101.325KPa 和 298.15K 时,测得 Fe 3+ /Fe 2+ 电对的电极电势 0.750V ,则该电极溶液中离子浓度是多少?
A.
c (Fe 3+ ) < 1 mol·dm -3
B.
c (Fe 3+ ) > 1 mol·dm -3
C.
c (Fe 3+ )/( Fe 2+ ) < 1
D.
c (Fe 3+ )/(Fe 2+ ) > 1
【判断题】在磷酸钠溶液中,钠离子浓度是磷酸根离子浓度的3倍。
A.
正确
B.
错误
【单选题】反应: 在298K时各离子浓度均为0.10 mol·L -1 时自发向右进行。下列叙述中正确的是()。
A.
E ;
B.
;
C.
E=0.10E ;
D.
E >0,但E<0。
【单选题】如果 HgCl 2 的 K SP = 4 ́ 10 -15 , 则 HgCl 2 的饱和溶液中 Cl - 离子浓度 (mol·dm -3 ) 是
A.
8 ´ 10 -15
B.
2 ´ 10 -15
C.
1 ´ 10 -5
D.
2 ´ 10 -5
【单选题】细胞外液钠离子浓度降低可导致
A.
静息电位不变、锋电位减小
B.
静息电位减小、锋电位增大
C.
静息电位增大、锋电位减小
D.
静息电位和锋电位都减小
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
A.
-2878kJ/mol
B.
-2658kJ/mol
C.
-1746kJ/mol
D.
-1526kJ/mol
【单选题】下列电对中,电极电位E随H离子浓度增大而增高的是
A.
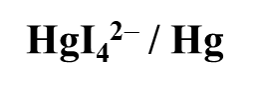
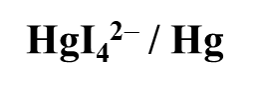
B.
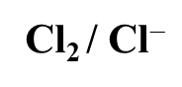
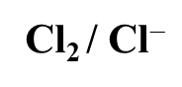
C.
AgCl / Ag
D.


【判断题】溶液中,氢离子浓度为0.01M,其溶液的PH值为2。 ( )
A.
正确
B.
错误
【单选题】下列为弱电解质的是( )
A.
HAc
B.
NaAc
C.
NaCl
D.
HCl

