
下载APP

弱电解质电离的影响因素题库

题数
1075
考试分类
高中化学>弱电解质电离的影响因素
售价
¥30
收藏
分享
去刷题



章节目录
简介
高中化学-弱电解质电离的影响因素
...更多
题目预览
【简答题】

[1/1075]关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是 A.取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>nB.取等...
参考答案:
|
B
|
参考解析:
考查弱电解质的电离平衡
A:两溶液稀释相同倍数时,由于促进了弱酸的电离平衡,可电离出部分氢离子,醋酸的pH将小于盐酸,故为保证pH相同,醋酸稀释倍数应相对较大,正确
B:开始反应是两溶液的氢离子浓度相同,反应速率也应该相同,不正确
C:由于在中和过程中,醋酸可不断电离出氢离子,故醋酸消耗的碱相对多,正确
D:两溶液中分别存在电荷守恒:c(CH 3COO -)+c(OH -)=c(H +)、c(Cl -)+c(OH -)=c(H +),由于两溶液的pH相同,可得出c(CH 3COO -)=c(Cl -),正确
答案为B
A:两溶液稀释相同倍数时,由于促进了弱酸的电离平衡,可电离出部分氢离子,醋酸的pH将小于盐酸,故为保证pH相同,醋酸稀释倍数应相对较大,正确
B:开始反应是两溶液的氢离子浓度相同,反应速率也应该相同,不正确
C:由于在中和过程中,醋酸可不断电离出氢离子,故醋酸消耗的碱相对多,正确
D:两溶液中分别存在电荷守恒:c(CH 3COO -)+c(OH -)=c(H +)、c(Cl -)+c(OH -)=c(H +),由于两溶液的pH相同,可得出c(CH 3COO -)=c(Cl -),正确
答案为B
【简答题】

[2/1075]25℃时,有下列四种溶液: ①②③④0.1 mol·L-1氨水pH=11氨水0.1 mol·L-1盐酸pH=3盐酸 下列说法正确的是 A....
参考答案:
|
D
|
参考解析:
A、氨水是弱电解质,存在电离平衡,稀释100倍,pH值变化小于2,错误;B、等体积①③混合得到氯化铵,水解呈酸性;等体积②④混合得到氯化铵与氨水混合物,氨水电离为主,溶液为碱性,错误;C、加入的CH 3COONa固体水解呈碱性,抑制氨水的电离,比值变大,错误;D、溶液为等浓度的氨水和氯化铵溶液混合,存在氨水的电离平衡和铵根离子的水解平衡,根据溶液为碱性,确定以氨水的电离平衡为主,则有c(NH 4 +) >c(Cl -)>c(NH 3·H 2O)>c(OH -)>c(H +),正确。
【简答题】

[3/1075]一定温度下,下列溶液的离子浓度关系式正确的是 A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1B.pH=a的氨水溶...
参考答案:
|
D
|
参考解析:
A、H 2S溶液中,存在H 2S
 H
+ + HS
-、HS
-
H
+ + HS
-、HS
-
 H
+ + S
2-、H
2O
H
+ + S
2-、H
2O
 H
+ + OH
-,根据上述反应知,pH=5的H
2S溶液中,c(H
+)=1×10
—5 mol·L
—1> c(HS
-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H
2C
2O
4溶液与pH=12的NaOH溶液任意比例混合:c(Na
+)+ c(H
+)= c(OH
-)+c( HC
2O
4
-)+2 c( C
2O
4
2
-),错误;D、酸性:CH
3COOH>H
2CO
3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH
3COONa②NaHCO
3③NaClO三种溶液的c(Na
+):①>②>③,正确。
H
+ + OH
-,根据上述反应知,pH=5的H
2S溶液中,c(H
+)=1×10
—5 mol·L
—1> c(HS
-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H
2C
2O
4溶液与pH=12的NaOH溶液任意比例混合:c(Na
+)+ c(H
+)= c(OH
-)+c( HC
2O
4
-)+2 c( C
2O
4
2
-),错误;D、酸性:CH
3COOH>H
2CO
3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH
3COONa②NaHCO
3③NaClO三种溶液的c(Na
+):①>②>③,正确。
【简答题】

[4/1075]下列关于电离平衡常数(K)的说法中正确的是 A.电离平衡常数(K)越小,表示弱电解质电离能力越弱B.电离平衡常数(K)与温度无关C.不同浓度的同一弱电...
参考答案:
|
A
|
参考解析:
无
【简答题】

[5/1075]为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验: 0.10 mol/L醋酸溶液、0.10 mol/L醋酸钠溶液、pH=...
参考答案:
|
(1)正确 (2)b<a+2 (3)能 (4)正确
|
参考解析:
(1)正确,若醋酸为强酸,则其溶液的pH=1,现醋酸溶液pH=4,说明醋酸没有完全电离,存在电离平衡。
(2)假设如果它是强酸,稀释100倍,溶液的pH=a+2,因为它是弱酸,故pH<a+2。
(3)能,加入醋酸钠晶体,颜色变橙色,说明溶液的酸性变弱,CH 3COO -抑制了醋酸的电离,故醋酸为弱电解质。
(4)正确,由题意知,醋酸钠溶液呈碱性,说明醋酸钠中的醋酸根离子发生了水解,故醋酸为弱酸
(2)假设如果它是强酸,稀释100倍,溶液的pH=a+2,因为它是弱酸,故pH<a+2。
(3)能,加入醋酸钠晶体,颜色变橙色,说明溶液的酸性变弱,CH 3COO -抑制了醋酸的电离,故醋酸为弱电解质。
(4)正确,由题意知,醋酸钠溶液呈碱性,说明醋酸钠中的醋酸根离子发生了水解,故醋酸为弱酸
【简答题】

[6/1075]下列不能证明一元酸HA为弱酸的是( ) A.NaA溶液的pH>7(室温下)B.pH试纸显示0.1 mol/L HA溶...
参考答案:
|
D
|
参考解析:
室温下,强碱弱酸盐由于水解,其溶液的pH>7,故A能够证明一元酸HA为弱酸,故A不能选;若一元酸HA为强酸,则0.1 mol/L HA溶液的pH在室温下应该为1,而用pH试纸显示0.1 mol/L HA溶液的pH为2~3,说明HA为弱酸,故B不能选;0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强,这可以说明一元酸HA为弱酸,故C正确;HA溶液能与CH 3COONa溶液反应生成CH 3COOH,只能说明HA的酸性比醋酸强,但是否为弱酸还不能确定,故D为本题的正确答案。
点评:本题考查了怎样判断一个酸为弱酸,属于对基础知识的考查,本题难度不大。
【简答题】

[7/1075]某二元酸(用H 2A表示)在水中的电离方程式是:H 2A=H ++HA -,HA - 【图片】H ++A 2-。回答以下问题: (1)NaHA溶液__...
参考答案:
|
(1)显酸性 HA
-只电离不水解 (2)BC
|
参考解析:
无
【简答题】

[8/1075]常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则 【图片】A.b、c两点溶液的导电能力相同B.c点溶液中 【...
参考答案:
|
C
|
参考解析:
氢氧化钠溶液中的氢氧根离子主要是氢氧化钠电离出来的,氢氧化钠完全电离,体积和pH都相同的氢氧化钠和醋酸钠溶液加水稀释的过程中,NaOH不能继续电离,NaOH溶液中氢氧根离子浓度变化大;水解是微弱的,醋酸钠溶液中醋酸根离子可继续水解,溶液中的氢氧根离子浓度变化小,所以含b点的曲线pH变化是NaOH溶液的,含a、c点的曲线pH变化是醋酸钠溶液的;A、溶液的导电能力和溶液中自由移动离子的浓度有关,b、c两点溶液pH相同,但其他离子浓度不一样,所以导电能力不一样,故A错误;B、c点溶液中,根据质子守恒,得出c(OH -)=c(H +)+c(CH 3COO -),故B错误;C、NaOH电离出的氢氧根离子浓度抑制了水的电离,所以b点溶液中水的电离程度最小;水解促进水的电离,由于醋酸钠溶液中的氢氧根离子浓度来自于醋酸根离子水解生成的氢氧根离子,氢氧根离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH大于c点的pH,说明a点氢氧根离子浓度大于c点氢氧根离子,所以a、c二点溶液水的电离程度a>c,综上所述a、b、c三点溶液水的电离程度a>c>b,故C正确;D、用等浓度NaOH溶液和等体积b、c处溶液反应,c点为醋酸根水解导致溶液呈碱性,c点溶液中醋酸根和氢氧根离子均消耗HCl,而b点只有NaOH消耗盐酸(NaOH完全电离),故消耗HCl溶液体积V c<V b,故D错误。
【简答题】

[9/1075]下列叙述不正确的是 A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—)B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)< 【图...
参考答案:
|
C
|
参考解析:
A、根据电荷守恒,稀盐酸中c(H +)=c(Cl —)+c(OH —)成立,正确;B、硝酸的存在对水的电离起抑制作用,所以水电离出的c(H +)<
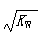 ,正确;C、盐的水解是吸热反应,加热促进水解,但第二步
,正确;C、盐的水解是吸热反应,加热促进水解,但第二步
水解非常微弱,所以不会有二氧化碳气体放出,平衡不会一直正向移动,因此最终得到的仍是碳酸钠固体,错误;D、酸与碱完全中和,所得溶液的pH大于7、小于7、等于7都有可能,依据酸、碱的强弱决定,正确,答案选C。
【简答题】

[10/1075]能证明醋酸是弱酸的事实是( ) A.能溶于水B.常温下,0.1 mol·Lˉ1醋酸溶液中的c(H+)为1.32×1...
参考答案:
|
B
|
参考解析:
在溶液中没有完全电离,存在电离平衡的电解质是弱电解质,A不正确,电解质的强弱与溶解性无关。C、D都不正确,只能说明醋酸显酸性。B中说明醋酸没有完全电离是弱电解质,所以正确的答案选B。