
下载APP

【简答题】


已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
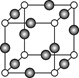
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】关于原子轨道的说法正确的是
A.
凡是中心原子采取sp 3 杂化轨道成键的分子其立体构型都是正四面体形
B.
CH 4 分子中sp 3 杂化轨道是4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.
sp 3 杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合形成的一组能量相近的新轨道
D.
凡AB 3 型的共价化合物,其中心原子A均采用sp 3 杂化轨道成键

