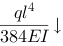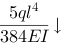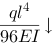下载APP

【简答题】


反应C2H5I+OH-====C2H2OH+I-在289K时的k1=5.03×10-2dm3·mol-1·s-1,而在333K时的k2=6.71dm3·mol-1·s-1,计算该反应的活化能是多少?在305K时的速率常数k3是多少?
举报
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】一个反应的活化能是33kJ·mol-1, 当T= 300K时,温度每增加1K,反应速率常数增加的百分数约是:()
A.
4.5%
B.
90%
C.
11%
D.
50%
【单选题】某反应的活化能为150.5 kJ • mol-1,引入催化剂后反应的活化能降低至112.2 kJ • mo1-1,若反应的温度为100 K,则反应速率增加的倍数约为( )
A.
1 x 10 22
B.
1 x 10 21
C.
1 x 1 0 20
D.
1 x 10 19
【单选题】关于化学反应速率常数k的说法正确的是:
A.
k值较大的反应,其反应速率在任何情况下都大
B.
通常一个反应的温度越高,其k值越大
C.
一个反应的k值大小与反应的性质无关
D.
通常一个反应的浓度越大,其k值越大
【单选题】某基元反应的Δ rH m Θ = -150 kJ · mol -1 ,则其正反应活化能
A.
可以大于或小于 150 kJ · mol - 1
B.
必定大于或等于150 kJ · mol -1
C.
必定等于或小于 150 kJ · mol - 1
D.
只能小于 150 kJ · mol - 1