
下载APP

【简答题】


已知:在室温时H 2O
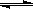 H ++OH - K W=10 -14 CH 3COOH
H ++OH - K W=10 -14 CH 3COOH
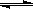 H ++ CH 3COO - Ka=1.8×10 -5 (1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H +)与C(CH 3COOH)的比值 (填“增大”或“减小”或“不变”) (2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH —)将 (填“增大”“减小”“不变”); (3)0.5mol·L -1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L -1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”); (4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。 (5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na +)_______________ c(CH 3COO -)(填“大于”、“小于”或“等于”), (6)室温时,若由pH=3的HA溶液V 1mL与pH=11的NaOH溶液V 2 mL混合,则下列说法 不正确的是____________。 A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 B.若V1=V2,反应后溶液pH一定等于7 C.若反应后溶液呈酸性,则V1一定大于V2 D.若反应后溶液呈碱性,则V1一定小于V2 (7)在某溶液中含Mg 2+、Cd 2+、Zn 2+三种离子的浓度均为0.01mol·L -1。向其中加入固 体醋酸钠后测得溶液的C(OH -)为2.2×10 -5mol·L -1,以上三种金属离子中 能生成沉淀,原因是 。 (K SP[Mg(OH) 2]=1.8×10 -11、K SP[Zn(OH) 2]=1.2×10 -17、 K SP[Cd(OH) 2]=2.5×10 -14) (8)取10mL0.5mol·L -1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H +) = mol/L。
H ++ CH 3COO - Ka=1.8×10 -5 (1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H +)与C(CH 3COOH)的比值 (填“增大”或“减小”或“不变”) (2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH —)将 (填“增大”“减小”“不变”); (3)0.5mol·L -1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L -1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”); (4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。 (5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na +)_______________ c(CH 3COO -)(填“大于”、“小于”或“等于”), (6)室温时,若由pH=3的HA溶液V 1mL与pH=11的NaOH溶液V 2 mL混合,则下列说法 不正确的是____________。 A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 B.若V1=V2,反应后溶液pH一定等于7 C.若反应后溶液呈酸性,则V1一定大于V2 D.若反应后溶液呈碱性,则V1一定小于V2 (7)在某溶液中含Mg 2+、Cd 2+、Zn 2+三种离子的浓度均为0.01mol·L -1。向其中加入固 体醋酸钠后测得溶液的C(OH -)为2.2×10 -5mol·L -1,以上三种金属离子中 能生成沉淀,原因是 。 (K SP[Mg(OH) 2]=1.8×10 -11、K SP[Zn(OH) 2]=1.2×10 -17、 K SP[Cd(OH) 2]=2.5×10 -14) (8)取10mL0.5mol·L -1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H +) = mol/L。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】在EDTA配位滴定中,要求指示剂(In)与金属离子(M)所形成的配合物(MIn)的稳定常数应()。
A.
K MIn ﹤ K MY
B.
K MIn ﹥ K MY
C.
K MIn 越小越好
D.
K MIn 越大越好
相关题目:

【单选题】EDTA与金属离子生成()
A.
螯合物
B.
聚合物
C.
离子交换剂
D.
非化学计量的化合物
【多选题】EDTA与金属离子形成的配合物的特点是( )。
A.
形成的配合物相当稳定
B.
计算关系简单
C.
反应迅速
D.
不改变反应物颜色
E.
生成的反应物颜色会改变
【单选题】用草酸标定氢氧化钠溶液时,氢氧化钠与草酸反应的化学计量比为( )。
A.
1:2
B.
2:1
C.
1:1
D.
1:3
【单选题】青霉素钠在氢氧化钠溶液中加热生成
A.
青霉酸
B.
青霉胺和青霉醛
C.
青霉二酸
D.
6-氨基青霉烷酸
E.
青霉羟肟酸
【单选题】将20克10%的盐酸和20克10%的氢氧化钠溶液混合后,滴入石蕊溶液,溶液为 ( )
A.
紫色
B.
蓝色
C.
红色
D.
无法判断
【判断题】制剂中微量金属离子不会影响药物的稳定性。( )
A.
正确
B.
错误
【单选题】在EDTA配位滴定中,要求指示剂(In)与金属离子(M)所形成的配合物(MIn)的稳定常数应()。
A.
K MIn ﹤ K MY
B.
K MIn ﹥ K MY
C.
K MIn 越小越好
D.
K MIn 越大越好
【单选题】EDTA能与许多的金属离子(如Ca2+)形成配位比为( )的稳定的配合物。
A.
1:6
B.
1:4
C.
1:1
D.
视反应条件而定
【多选题】含皂苷成分的中药不宜与含有金属离子的盐类药物联用的有()
A.
硫酸亚铁
B.
碱式碳酸铋
C.
磷化铝
D.
碳酸锌
E.
硅酸镁
【单选题】金属离子与EDTA所成配位化合物的稳定常数
A.
B.
C.
D.
E.
【单选题】EDTA与金属离子形成络合物时,络合比为( )。
A.
1:1
B.
1:2
C.
2:1
D.
1:3

