
下载APP

【简答题】


在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
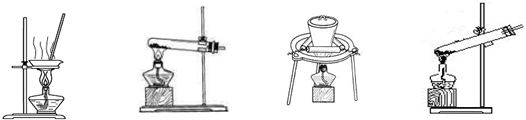
A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入
振荡,观察
现象:溶液中产生大量白色沉淀;
结论: 。
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 ,
振荡,观察
现象: ;
结论:样品中含有NaHCO3。
步骤三:将步骤二的浊液过滤,取滤液于试管C中,
振荡,观察
现象: ;
结论: 。
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当 ,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度: mg/L(Cl的相对原子质量:35.5)
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(g)+O 2 (g )═CO 2 (g),△H 1 ; C(g)+ 1 2 O 2 (g)═CO(g ),△H 2 ; ②S(s)+O 2 (g )═SO 2 (g),△H 3 ; S(g)+O 2 (g)═SO 2 (g),△H 4 ; ③H 2 (g)+ 1 2 O 2 (g )═H 2 O(l),△...
A.
①②③
B.
②③④
C.
④
D.
①
【单选题】已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
A.
N2H4+O2=N2+2H2O△H= —534.4kJ/mol
B.
N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol
C.
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol
D.
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol
【单选题】已知热化学方程式:SO 2(g)+ O 2(g) SO 3(g) △H =" ―98.32" kJ/mol,在容器中充入2molSO 2 和1molO 2充分反应,最终放出的热量为
A.
196.kJ
B.
196.kJ/mol
C.
<196.kJ
D.
>196.kJ
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量
【单选题】下列化学方程式书写不正确的是( )
A.
4P+5O2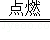 2P2O5
2P2O5
 2P2O5
2P2O5B.
Zn+H2SO4═ZnSO4+H2↑
C.
CH4+O2 CO2+H2O
CO2+H2O
 CO2+H2O
CO2+H2OD.
2H2O2═O2↑+2H2O
【单选题】Cu 20g与硫酸反应的化学方程式为Cu 2 O+H 2 SO 4 =Cu+CuSO 4 +H 2 O。氧化铜与氢气反应后得到的Cu中常常混有少量Cu 2 O。现将10 g Cu和Cu 2 O的混合物放入足量的稀硫酸中充分反应,过滤得到9.5g固体,则原混合物中含Cu 2 O的质量为 [ ]
A.
0.9 g
B.
9.5 g
C.
0.5 g
D.
0.45 g
【单选题】将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料X和水,其反应的化学方程式为:CO2 + 3H2 =X + H2O。下列有关这个反应的说法中不正确的是( )
A.
X是有机化合物
B.
X的化学式为CH4O
C.
该反应为置换反应
D.
这个反应开辟了二氧化碳的一个新用途
【单选题】已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,则表示该反应的热化学方程式正确的是
A.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) Δ H =+ 890.3 kJ · mol ˉ 1
B.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) Δ H =- 890.3 kJ · mol ˉ 1
C.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) Δ H =+ 890.3 kJ · mol ˉ 1
D.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) Δ H =- 890.3 kJ · mol ˉ 1
【单选题】化学方程式符合题意且书写正确的是()
A.
用胃舒乳[Mg(OH)2]治疗胃酸过多:Mg(OH)2 + H2SO4 → MgSO4+ 2H2O
B.
用稀盐酸除铁锈:Fe2O3 + 6HCl → 2FeCl3 + 3H2O
C.
细铁丝在氧气中燃烧 4Fe+3O2 2Fe2O3
2Fe2O3
 2Fe2O3
2Fe2O3D.
除去混在NaCl溶液中的少量MgCl2:2KOH+MgCl2 →2KCl+Mg(OH)2↓
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
A.
-2878kJ/mol
B.
-2658kJ/mol
C.
-1746kJ/mol
D.
-1526kJ/mol
相关题目:

【单选题】已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
A.
N2H4+O2=N2+2H2O△H= —534.4kJ/mol
B.
N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol
C.
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol
D.
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol
【单选题】已知热化学方程式:SO 2(g)+ O 2(g) SO 3(g) △H =" ―98.32" kJ/mol,在容器中充入2molSO 2 和1molO 2充分反应,最终放出的热量为
A.
196.kJ
B.
196.kJ/mol
C.
<196.kJ
D.
>196.kJ
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量
【单选题】下列化学方程式书写不正确的是( )
A.
4P+5O2 2P2O5
2P2O5
 2P2O5
2P2O5B.
Zn+H2SO4═ZnSO4+H2↑
C.
CH4+O2 CO2+H2O
CO2+H2O
 CO2+H2O
CO2+H2OD.
2H2O2═O2↑+2H2O
【单选题】将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料X和水,其反应的化学方程式为:CO2 + 3H2 =X + H2O。下列有关这个反应的说法中不正确的是( )
A.
X是有机化合物
B.
X的化学式为CH4O
C.
该反应为置换反应
D.
这个反应开辟了二氧化碳的一个新用途
【单选题】已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,则表示该反应的热化学方程式正确的是
A.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) Δ H =+ 890.3 kJ · mol ˉ 1
B.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) Δ H =- 890.3 kJ · mol ˉ 1
C.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) Δ H =+ 890.3 kJ · mol ˉ 1
D.
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) Δ H =- 890.3 kJ · mol ˉ 1
【单选题】化学方程式符合题意且书写正确的是()
A.
用胃舒乳[Mg(OH)2]治疗胃酸过多:Mg(OH)2 + H2SO4 → MgSO4+ 2H2O
B.
用稀盐酸除铁锈:Fe2O3 + 6HCl → 2FeCl3 + 3H2O
C.
细铁丝在氧气中燃烧 4Fe+3O2 2Fe2O3
2Fe2O3
 2Fe2O3
2Fe2O3D.
除去混在NaCl溶液中的少量MgCl2:2KOH+MgCl2 →2KCl+Mg(OH)2↓
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
A.
-2878kJ/mol
B.
-2658kJ/mol
C.
-1746kJ/mol
D.
-1526kJ/mol

