
下载APP

【简答题】


实验室用下列方法测定某水样中O 2的含量。
 (1)用如图所示装置,使水中溶解的O 2在碱性条件下将Mn 2 +氧化成MnO(OH) 2的反应的离子方程式为______________________________________。 实验步骤: ①打开止水夹a和b,从A处向装置内鼓入过量N 2,此操作的目的是______________________________________。 ②用注射器抽取20.00 mL某水样从A处注入锥形瓶。 ③再分别从A处注入含m mol NaOH的溶液及过量的MnSO 4溶液。 ④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。 (2)用I -将生成的MnO(OH) 2再还原为Mn 2 +,反应的离子方程式为MnO(OH) 2+2I -+4H +===Mn 2 ++I 2+3H 2O。 实验步骤: ⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H 2SO 4的硫酸溶液。 ⑥重复④的操作。 (3)用Na 2S 2O 3标准溶液滴定步骤(2)中生成的I 2,反应的化学方程式为I 2+2Na 2S 2O 3===2NaI+Na 2S 4O 6。 实验步骤: ⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。 ⑧用0.005 mol·L -1的Na 2S 2O 3滴定至终点。 (4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。
(1)用如图所示装置,使水中溶解的O 2在碱性条件下将Mn 2 +氧化成MnO(OH) 2的反应的离子方程式为______________________________________。 实验步骤: ①打开止水夹a和b,从A处向装置内鼓入过量N 2,此操作的目的是______________________________________。 ②用注射器抽取20.00 mL某水样从A处注入锥形瓶。 ③再分别从A处注入含m mol NaOH的溶液及过量的MnSO 4溶液。 ④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。 (2)用I -将生成的MnO(OH) 2再还原为Mn 2 +,反应的离子方程式为MnO(OH) 2+2I -+4H +===Mn 2 ++I 2+3H 2O。 实验步骤: ⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H 2SO 4的硫酸溶液。 ⑥重复④的操作。 (3)用Na 2S 2O 3标准溶液滴定步骤(2)中生成的I 2,反应的化学方程式为I 2+2Na 2S 2O 3===2NaI+Na 2S 4O 6。 实验步骤: ⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。 ⑧用0.005 mol·L -1的Na 2S 2O 3滴定至终点。 (4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。
 ⑨经计算,此水样中氧(O 2)的含量为________mg·L -1。
⑨经计算,此水样中氧(O 2)的含量为________mg·L -1。
举报
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】甲乙两烧杯中分别盛有等体积、等浓度的硫酸溶液.向甲杯中放入m克镁,向乙杯中投入m克锌.完全反应后发现有一烧杯中金属有剩余.则各杯中原来硫酸的质量x之值是 [ ]
A.
x=
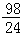 m克
m克
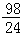 m克
m克B.
 m>x>
m>x>
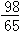 m
m
 m>x>
m>x>
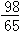 m
mC.
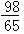 m>x≥
m>x≥
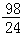 m
m
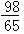 m>x≥
m>x≥
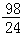 m
mD.
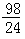 m>x≥
m>x≥
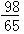 m
m
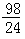 m>x≥
m>x≥
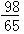 m
m【单选题】C(H2SO4)0.1mol/L硫酸溶液100mL中所含H2SO4质量为()。(注:H2SO4分子量为98)
A.
4.9克
B.
9.88克
C.
0.49克
D.
0.98克