
下载APP

【简答题】


绿矾(FeSO 4 ·7H 2 O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。 (1)98% 1.84 g/cm 3 的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm 3 ,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO 3 20克)配制稀硫酸,若用SO 3 ·nH 2 O表示20%的发烟硫酸,则n=____________(保留两位小数)。 (3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl 2 溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe 2 + 完全氧化,推测晶体的化学式为 。 (4)硫酸亚铁铵[(NH 4 ) 2 SO 4 ·FeSO 4 ·6H 2 O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe 2+ 的标准溶液,用此Fe 2+ 的标准溶液可以测定剩余稀硝酸的量。现取8.克Cu 2 S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下: 10NO 3 - +3Cu 2 S+16H + →6Cu 2 + +10NO↑+3SO 4 2- +8H 2 O 8NO 3 - +3CuS+8H + → 3Cu 2 + +3 SO 4 2- +8NO↑+ 4H 2 O 剩余的稀硝酸恰好与V mL 2 mol/L (NH 4 ) 2 Fe(SO 4 ) 2 溶液完全反应。 已知:NO 3 - +3Fe 2 + +4H + → NO↑+3Fe 3+ +2H 2 O ① V值范围 ; ② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】甲乙两烧杯中分别盛有等体积、等浓度的硫酸溶液.向甲杯中放入m克镁,向乙杯中投入m克锌.完全反应后发现有一烧杯中金属有剩余.则各杯中原来硫酸的质量x之值是 [ ]
A.
x=
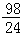 m克
m克
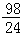 m克
m克B.
 m>x>
m>x>
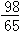 m
m
 m>x>
m>x>
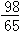 m
mC.
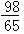 m>x≥
m>x≥
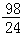 m
m
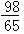 m>x≥
m>x≥
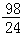 m
mD.
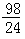 m>x≥
m>x≥
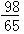 m
m
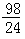 m>x≥
m>x≥
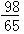 m
m【单选题】C(H2SO4)0.1mol/L硫酸溶液100mL中所含H2SO4质量为()。(注:H2SO4分子量为98)
A.
4.9克
B.
9.88克
C.
0.49克
D.
0.98克
【单选题】欲配制浓度为T=0.5mgCl-/mL的硝酸银标准溶液2000mL,需称()硝酸银。(Cl-的摩尔质量为35.5g/mol;AgNO3的摩尔质量为169.9g/mol)
A.
4.8克
B.
3.5克
C.
2.8克
D.
17克
【单选题】取水样100mL,用c(EDTA)=0.0200mol/L标准溶液测定水的总硬度,用去4.00mL,计算水的总硬度是( )(用CaCO3mg/L表示)。
A.
20mg/L
B.
40mg/L
C.
60mg/L
D.
80mg/L

