
下载APP

【简答题】


氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题: (1) 被称为万能还原剂的NaBH 4溶于水并和水反应:NaBH 4+2H 2O=NaBO 2+4H 2↑,此反应中B元素的化合价没有发生变化,则NaBH 4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。 (2) 有下列三个反应: ①Cl 2+FeI 2=FeCl 2+I 2 ;②2Fe 2++Br 2=2Fe 3++2Br -;③Co 2O 3+6HCl=2CoCl 2+Cl 2↑+3H 2O ①根据以上方程式可以得到Fe 2+、Co 2+、Br -、I -还原性由强的弱的顺序为_________; ②1molCo 2O 3能氧化HCl的物质的量_____________。 (3) 完成并配平下列化学反应方程式: □KMnO 4+□H 2C 2O 4+□________
 □CO 2+□K 2SO 4+□MnSO 4+□H 2O (4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H + +Zn=Zn 2++H 2↑,可拆写为氧化反应式:Zn-2e -=Zn 2+,还原反应式:2H ++ 2e -=H 2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题: ①将2Fe 3++Cu= 2Fe 2+ +Cu 2+拆写为两个“半反应式”:其中,氧化反应式为 。 ②由①中的反应,可设计成如右图所示的原电池:
□CO 2+□K 2SO 4+□MnSO 4+□H 2O (4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H + +Zn=Zn 2++H 2↑,可拆写为氧化反应式:Zn-2e -=Zn 2+,还原反应式:2H ++ 2e -=H 2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题: ①将2Fe 3++Cu= 2Fe 2+ +Cu 2+拆写为两个“半反应式”:其中,氧化反应式为 。 ②由①中的反应,可设计成如右图所示的原电池:
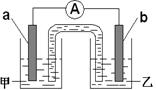 若电极a为Cu ,电解质溶液甲的化学式为 ; 电极b处的电极反应式为 。
若电极a为Cu ,电解质溶液甲的化学式为 ; 电极b处的电极反应式为 。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】科尔劳施定律认为电解质溶液的摩尔电导与其浓度成线性关系为(如下)。 这一规律适用于:
A.
弱电解质
B.
强电解质的稀溶液
C.
无限稀溶液
D.
b = 1 mol·kg -1 的溶液
【单选题】判断给定化学反应是否为氧化还原反应的依据是[ ]
A.
看反应前后是否有氧原子的得失
B.
看反应前后是否有原子的重新组合
C.
看反应前后是否有电子的得失或偏移
D.
看反应前后是否有元素的化合价发生改变
【单选题】下列电解质溶液中,离子平均活度系数最大的是 ( ) ( 设浓度都为 0.01 mo l ·kg - 1 )。
A.
KCl
B.
CaCl 2
C.
Na 2 SO 4
D.
AlCl 3

