
下载APP

【简答题】


某研究小组欲探究SO2的化学性质,设计了如下实验方案.
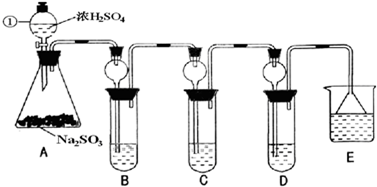 (1)指出仪器①的名称______.(2)检查A装置的气密性的方法是______.(3)装置B检验SO2的氧化性,则B中所盛试剂可以为______.(4)装置C中盛装溴水用以检验SO2的______性,则C中反应的离子方程式为______.(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:①假设一:该白色沉淀为CaSO3假设二:该白色沉淀为______.假设三:该白色沉淀为上述两种物质的混合物.②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.第1步,将D中沉淀过滤、洗涤干净,备用.请回答洗涤沉淀的方法:______.第2步,用另一只干净试管取少量沉淀样品,加入______(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有______(试剂)的试管中.若出现______现象,则假设一成立.③若假设二成立,试写出生成该白色沉淀的化学方程式:______.(6)装置E中盛放的试剂是______,作用是______.
(1)指出仪器①的名称______.(2)检查A装置的气密性的方法是______.(3)装置B检验SO2的氧化性,则B中所盛试剂可以为______.(4)装置C中盛装溴水用以检验SO2的______性,则C中反应的离子方程式为______.(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:①假设一:该白色沉淀为CaSO3假设二:该白色沉淀为______.假设三:该白色沉淀为上述两种物质的混合物.②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.第1步,将D中沉淀过滤、洗涤干净,备用.请回答洗涤沉淀的方法:______.第2步,用另一只干净试管取少量沉淀样品,加入______(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有______(试剂)的试管中.若出现______现象,则假设一成立.③若假设二成立,试写出生成该白色沉淀的化学方程式:______.(6)装置E中盛放的试剂是______,作用是______.
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(g)+O 2 (g )═CO 2 (g),△H 1 ; C(g)+ 1 2 O 2 (g)═CO(g ),△H 2 ; ②S(s)+O 2 (g )═SO 2 (g),△H 3 ; S(g)+O 2 (g)═SO 2 (g),△H 4 ; ③H 2 (g)+ 1 2 O 2 (g )═H 2 O(l),△...
A.
①②③
B.
②③④
C.
④
D.
①
【单选题】已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
A.
N2H4+O2=N2+2H2O△H= —534.4kJ/mol
B.
N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol
C.
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol
D.
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol
【单选题】已知热化学方程式:SO 2(g)+ O 2(g) SO 3(g) △H =" ―98.32" kJ/mol,在容器中充入2molSO 2 和1molO 2充分反应,最终放出的热量为
A.
196.kJ
B.
196.kJ/mol
C.
<196.kJ
D.
>196.kJ
【多选题】下表所列各组化学反应甲与化学反应乙都可以用离子方程式丙表示的是( )
A.
甲:往少量NaOH溶液中投入铝片;乙:往过量NaOH溶液中投入铝片;丙:2Al+2OH-+2H2O═2AlO2-+3H2↑
B.
甲:向稀硝酸中加入少量铁片;乙:向稀硝酸中加入过量铁片;丙:Fe+NO3-+4H+═Fe3++NO↑+2H2O
C.
甲:向FeCl3溶液中加少量铜片;乙:向FeCl3溶液中加过量铜片;丙:2Fe3++Cu═2Fe2++Cu2+
D.
甲:往NaOH溶液中通入过量CO2气体;乙:往NaOH溶液中通入少量CO2气体;丙:CO2+OH-═HCO3-
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量
【单选题】将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料X和水,其反应的化学方程式为:CO2 + 3H2 =X + H2O。下列有关这个反应的说法中不正确的是( )
A.
X是有机化合物
B.
X的化学式为CH4O
C.
该反应为置换反应
D.
这个反应开辟了二氧化碳的一个新用途
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
A.
-2878kJ/mol
B.
-2658kJ/mol
C.
-1746kJ/mol
D.
-1526kJ/mol
相关题目:

【单选题】已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
A.
N2H4+O2=N2+2H2O△H= —534.4kJ/mol
B.
N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol
C.
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol
D.
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol
【单选题】已知热化学方程式:SO 2(g)+ O 2(g) SO 3(g) △H =" ―98.32" kJ/mol,在容器中充入2molSO 2 和1molO 2充分反应,最终放出的热量为
A.
196.kJ
B.
196.kJ/mol
C.
<196.kJ
D.
>196.kJ
【多选题】下表所列各组化学反应甲与化学反应乙都可以用离子方程式丙表示的是( )
A.
甲:往少量NaOH溶液中投入铝片;乙:往过量NaOH溶液中投入铝片;丙:2Al+2OH-+2H2O═2AlO2-+3H2↑
B.
甲:向稀硝酸中加入少量铁片;乙:向稀硝酸中加入过量铁片;丙:Fe+NO3-+4H+═Fe3++NO↑+2H2O
C.
甲:向FeCl3溶液中加少量铜片;乙:向FeCl3溶液中加过量铜片;丙:2Fe3++Cu═2Fe2++Cu2+
D.
甲:往NaOH溶液中通入过量CO2气体;乙:往NaOH溶液中通入少量CO2气体;丙:CO2+OH-═HCO3-
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量
【单选题】将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料X和水,其反应的化学方程式为:CO2 + 3H2 =X + H2O。下列有关这个反应的说法中不正确的是( )
A.
X是有机化合物
B.
X的化学式为CH4O
C.
该反应为置换反应
D.
这个反应开辟了二氧化碳的一个新用途
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
A.
-2878kJ/mol
B.
-2658kJ/mol
C.
-1746kJ/mol
D.
-1526kJ/mol

