下载APP

【简答题】


重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr 2O 3,以及SiO 2、Al 2O 3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K 2Cr 2O 7的主要工艺如下:
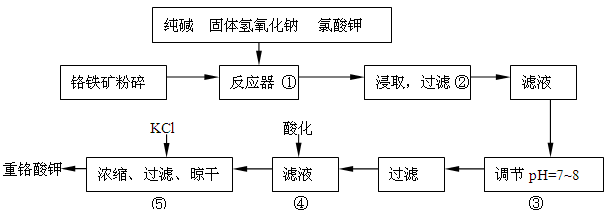 反应器中主要发生的反应为: Ⅰ.FeO·Cr 2O 3+NaOH+KClO 3→Na 2CrO 4+Fe 2O 3+H 2O+KCl(未配平) Ⅱ.Na 2CO 3+SiO 2 Δ Na 2SiO 3+CO 2↑ Ⅲ.Al 2O 3+2NaOH Δ 2NaAlO 2+H 2O 在步骤③中将溶液pH调节到7~8可以将SiO 3 2-和AlO 2 -转化为相应的沉淀除去。 (1)在反应Ⅰ中氧化剂是________,若有245g KClO 3参加反应,则转移的电子数为_____________。 (2)反应器中生成的Fe 2O 3又可和Na 2CO 3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________ ___________________________。 (3)操作④目的是将CrO 4 2-转化为Cr 2O 7 2-,其现象为__________________________,离子方程式为_______________________________________。 (4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母) A.重结晶 B.萃取分液 C.蒸馏 (5)分析产品中K 2Cr 2O 7的纯度是利用硫酸酸化的K 2Cr 2O 7将KI氧化成I 2,然后利用相关物质测出I 2的量从而获得K 2Cr 2O 7的量,写出酸化的K 2Cr 2O 7与KI反应的化学方程式________________________。
反应器中主要发生的反应为: Ⅰ.FeO·Cr 2O 3+NaOH+KClO 3→Na 2CrO 4+Fe 2O 3+H 2O+KCl(未配平) Ⅱ.Na 2CO 3+SiO 2 Δ Na 2SiO 3+CO 2↑ Ⅲ.Al 2O 3+2NaOH Δ 2NaAlO 2+H 2O 在步骤③中将溶液pH调节到7~8可以将SiO 3 2-和AlO 2 -转化为相应的沉淀除去。 (1)在反应Ⅰ中氧化剂是________,若有245g KClO 3参加反应,则转移的电子数为_____________。 (2)反应器中生成的Fe 2O 3又可和Na 2CO 3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________ ___________________________。 (3)操作④目的是将CrO 4 2-转化为Cr 2O 7 2-,其现象为__________________________,离子方程式为_______________________________________。 (4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母) A.重结晶 B.萃取分液 C.蒸馏 (5)分析产品中K 2Cr 2O 7的纯度是利用硫酸酸化的K 2Cr 2O 7将KI氧化成I 2,然后利用相关物质测出I 2的量从而获得K 2Cr 2O 7的量,写出酸化的K 2Cr 2O 7与KI反应的化学方程式________________________。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
A.
Q1<Q2
B.
生成物总能量均高于反应物总能量
C.
生成1molHCl气体时放出Q1热量
D.
1molHBr(g)具有的能量大于1molHBr(l)具有的能量