
下载APP

【简答题】


(3分)黄铜是由铜和锌所组成的合金,用途广泛。某兴趣小组为探究黄铜合金的组成,取20.00 g粉末状黄铜合金样品,把60.00 g稀硫酸平均分成三等份,分三次加入样品中,均有气体产生,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下: 第一次 第二次 第三次 剩余固体的质量/g 16.75 13.50 12.40 请计算:(要求写出计算过程) (1)该黄铜合金中,锌元素的质量分数。 (2)第二次实验中放出气体的质量。 (3)向三次实验后所得混合溶液中滴加BaCl 2 溶液,生成不溶于水的BaSO 4 白色沉淀。所得沉淀的质量与BaCl 2 溶液质量的关系如右图所示,求所用BaCl 2 溶液的溶质质量分数。
参考答案:


参考解析:




刷刷题刷刷变学霸
举一反三

【单选题】将相同体积、相同溶质质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中,生成H2的质量与反应时间的关系如图所示.下列说法中正确的是( )
A.
三种金属的活动性顺序为Y>X>Z
B.
产生氢气的速率顺序为X>Y>Z
C.
消耗稀盐酸的质量顺序为Z>Y>X
D.
相对原子质量由大到小的顺序为X>Y>Z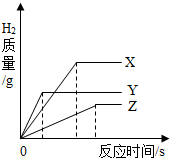

【单选题】实验室配制100g溶质质量分数为10%的食盐水,应选用的仪器是( )
A.
托盘天平、酒精灯、试管、药匙
B.
托盘天平、玻璃棒、烧杯、漏斗
C.
托盘天平、玻璃棒、烧杯、量筒
D.
托盘天平、铁架台、烧杯、量筒

