
下载APP

达到化学平衡的标志题库

题数
1055
考试分类
高中化学>达到化学平衡的标志
售价
¥30
收藏
分享
去刷题



章节目录
简介
高中化学-达到化学平衡的标志
...更多
题目预览
【简答题】

[1/1055](15分) A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示...
参考答案:
|
(1) c、d(各1分,写错1个扣1分,扣完2分止)
(2)4NH 3+5O 2 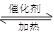 4NO + 6H
2O
(3分) 4NO + 6H
2O
(3分)
(3) B、C (各1分,写错1个扣1分,扣完2分止) (4) 0.075(2分) (5) ①40(2分) ②<(2分) ③>(2分) |
参考解析:
D为红综色气体,则D是NO
2。因此反应③是NO和氧气发生的氧化还原反应,即甲是氧气,C是NO。氧气和B反应生成物也是NO,这说明B是氨气,反应①属于氨的催化氧化,则A是H
2O,电解水得到氢气和氧气,属于乙是氢气。
(1)②③分别是分解反应和化合反应,①是氧化还原反应。
(2)氨气发生催化氧化的反应式为4NH 3+5O 2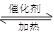 4NO + 6H
2O
4NO + 6H
2O
(3)反应③的反应式为2NO+O 2 2NO
2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
2NO
2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
(4) 2NO+O 2 2NO
2
2NO
2
起始量(mol) 2 1 0
转化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
所以有2-2x+1-x+2x=2.55
解得x=0.45mol
所以用甲表示的化学反应速率为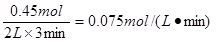
(5)正逆反应速率相等,说明反应达到平衡状态,所以平衡常数为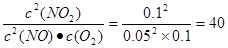 。在Ⅱ
。在Ⅱ
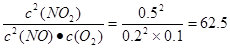 >40,所以正反应速率小于逆反应速率。在Ⅲ
>40,所以正反应速率小于逆反应速率。在Ⅲ
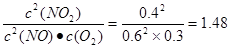 <40,所以正反应速率大于逆反应速率。
<40,所以正反应速率大于逆反应速率。
(1)②③分别是分解反应和化合反应,①是氧化还原反应。
(2)氨气发生催化氧化的反应式为4NH 3+5O 2
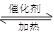 4NO + 6H
2O
4NO + 6H
2O
(3)反应③的反应式为2NO+O 2
 2NO
2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
2NO
2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
(4) 2NO+O 2
 2NO
2
2NO
2
起始量(mol) 2 1 0
转化量(mol) 2x x 2x
平衡量(mol) 2-2x 1-x 2x
所以有2-2x+1-x+2x=2.55
解得x=0.45mol
所以用甲表示的化学反应速率为
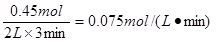
(5)正逆反应速率相等,说明反应达到平衡状态,所以平衡常数为
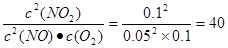 。在Ⅱ
。在Ⅱ
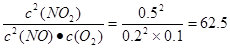 >40,所以正反应速率小于逆反应速率。在Ⅲ
>40,所以正反应速率小于逆反应速率。在Ⅲ
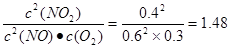 <40,所以正反应速率大于逆反应速率。
<40,所以正反应速率大于逆反应速率。
【简答题】

[2/1055]下列反应中符合下图图像的是 ( )。 【图片】A.N2(g)+3H2(g) 【图片】2NH3(g) ΔH=-Q1 kJ·mo...
参考答案:
|
B
|
参考解析:
无
【简答题】

[3/1055]( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的交化如下表: 时间/s 0 1 2 3 4 ...
参考答案:
(Ⅰ)、(1)可逆反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数k=
平衡常数K(300℃)>K(350℃),说明温度升高,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应是放热反应. 故答案为:
(2)NO2是产物,随反应进行浓度增大,平衡时c(NO2)为NO浓度的变化量△c(NO),由表中数据可知3s时反应达平衡,平衡是n(NO)=0.007mol,△n(NO)=0.02mol-0.007mol=0.013mol,故c(NO2)=△c(NO)=
2s内用NO表示的平均反应速率v(NO)=
所以v(O2)=
故答案为:b;1.5×10-3mol•L-1•s-1; (3)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误; b、随反应进行,反应混合气体总的物质的量在减小,压强减小,当压强不变,说明反应到达平衡,故b正确; c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确; d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误. 故答案为:bc. (4)可逆反应2NO(g)+O2(g)⇌2NO2(g)正反应是体积减小的放热反应. a.及时分离出NO2气体,瞬间逆反应速率减小,正反应速率不变,平衡向正反应进行,随后反应混合物各组分的浓度降低,速率减小,故a错误; b.升高温度反应速率增大,平衡向吸热反应移动,即平衡向逆反应移动,故b错误; c.增大O2的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应进行,随后生成物的浓度增大,逆反应速速率增大,故c正确; d.加入高效催化剂,同等程度增大正、逆反应速率,平衡不移动,故d错误. 故选:c. (Ⅱ)、(1)由给出电解质溶液可知,阴阳极都有气体产生,且体积比(相同条件下)为2:1的,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解池的阳极发生氧化反应,氢氧根在阳极放电,生成氧气与水,阳极电极反应式4OH--4e-=O2↑+2H2O; 总反应的化学方程式是2H2O
故答案为:①②⑤;4OH--4e-=O2↑+2H2O;2H2O
(2)由给出电解质溶液可知,阴阳极都有气体产生,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解后溶液的浓度增大,①稀H2SO4电解后溶液的酸性增强,溶液PH值不变,②K2SO4溶液是中性溶液,电解后溶液PH值不变,⑤KOH溶液电解后溶液的碱性增强,溶液PH值增大. 故答案为:①;⑤. (3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小,电解质的是④CuSO4溶液符合,电解硫酸铜溶液生成铜、氧气与硫酸,总反应的化学方程式为2CuSO4+2H2O
故答案为:④;2CuSO4+2H2O
|
参考解析:
c2(N
O2)
c2(NO)•c(
O2)
【简答题】

[4/1055]在恒温、恒容的条件下,有反应2A(g)+2B(g) 【图片】C(g)+3D(g),现从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L —...
参考答案:
|
AD
|
参考解析:
按照等效平衡的思想,途径I和途径II的物质起始浓度都满足系数之比,又在恒温、恒容的条件下进行,所以最终到平衡时,体系内混合气的百分组成相同;由于起始的浓度不一样,所以达平衡时,途径I的反应速率v(A)不等于途径II的反应速率v(A);途径I时物质浓度是途径II的1/2,故达平衡时,途径I所得混合气的密度为途径II所得混合气密度的1/2。
【简答题】

[5/1055]下列图示与对应的叙述相符的是 ( ) 【图片】 【图片】 【图片】 ...
参考答案:
|
A
|
参考解析:
A、由图1可知,T 2>T 1,温度越高,Y的含量越小,对于反应2X(g)?Y(g)△H<0,升高温度平衡向逆反应移动,Y的含量降低,图象与实际符合,故A正确;
B、由图可知,浓度相同的三种一元酸,滴定前pH值③<②<①,故③的酸性最强,故B错误;
C、由图象可知n(O 2)/n(SO 2)越大,氧气转化率越大,由反应2SO 2(g)+O 2(g)
 2SO
3(g),n(O
2)/n(SO
2)越大,SO
2的转化率越大,氧气转化率越小,图象与实际不相符,故C错误;
2SO
3(g),n(O
2)/n(SO
2)越大,SO
2的转化率越大,氧气转化率越小,图象与实际不相符,故C错误;
D、各时间段对应的纵坐标之差为该时间段生成的二氧化碳体积,由图可知t 1~t 2时间段生成的二氧化碳最多,故D错误;
故选A.
【简答题】

[6/1055]过程的自发性的作用是 A.判断过程的方向B.确定过程是否一定会发生C.判断过程发生的速率D.判断过程的热效应
参考答案:
|
A
|
参考解析:
过程的自发性只能判断过程的方向,而不能判断过程是否一定会发生或过程发生的速率,更不能判断过程的热效应,所以只有选项A正确,其余都是错误的,答案选A。
【简答题】

[7/1055](12分)为减弱温室效应,除了减少CO 2的排放、植树造林、将液态CO 2注入深海等措施外,还有一种思路是将CO 2转化成其它可燃物质。如工业上已实现...
参考答案:
|
(每空2分,共12分)
(1) _____10_ ___min(填“3”或“10”);_ ___0.075_ _ mol/(L·min)。 (2) a  b ;
b ;
(3) 增大 _(填“增大”或“减小”); (4)转化率是 _____75%______,平衡常数K=_____ __5.3_______。(计算结果保留一位小数) |
参考解析:
略
【简答题】

[8/1055]硫-碘循环分解水制氢主要涉及下列反应: Ⅰ.SO 2+2H 2O+I 2=H 2SO 4+2HI Ⅱ.2HI 【图片】H 2↑+I 2Ⅲ.2H 2SO...
参考答案:
|
(1)c (2)①0.1 mol·L
-1·min
-1 ②a (3)b
|
参考解析:
(1)根据题意可知,因为是分解水制取H
2的反应,所以应不断补充水,产生2 mol H
2时,生成1 mol O
2,c对、d错;硫酸常温不分解,a错;反应Ⅰ中SO
2为还原剂,HI为还原产物,还原性SO
2>HI,b错。
(2)①2 min时H 2的平衡浓度为0.1 mol·L -1,H 2的平均反应速率为
0.1 mol·L -1/2 min="0.05" mol·L -1·min -1,v(HI)=2v(H 2)="0.05" mol·L -1·min -1×2="0.1" mol·L -1·min -1。
②2HI H
2+I
2为反应前后气体体积不变的反应,在恒容容器中发生反应,HI的物质的量增加为原来的2倍,平衡不移动,但是反应速率加快,反应时间缩短,达到平衡时各组分浓度为原来的2倍,而体积分数不变。
H
2+I
2为反应前后气体体积不变的反应,在恒容容器中发生反应,HI的物质的量增加为原来的2倍,平衡不移动,但是反应速率加快,反应时间缩短,达到平衡时各组分浓度为原来的2倍,而体积分数不变。
(3)根据反应Zn+2H +=Zn 2 ++H 2↑可知,增大反应速率,只要增大H +浓度即可,NaHSO 3与H +反应,H +浓度减小,反应速率减小;Na 2SO 4对反应速率没影响;NaNO 3与H +结合会生成HNO 3,反应不产生H 2;只有CuSO 4合适,Zn+Cu 2 +=Cu+Zn 2+,Zn与生成的Cu形成原电池,反应速率加快。
(2)①2 min时H 2的平衡浓度为0.1 mol·L -1,H 2的平均反应速率为
0.1 mol·L -1/2 min="0.05" mol·L -1·min -1,v(HI)=2v(H 2)="0.05" mol·L -1·min -1×2="0.1" mol·L -1·min -1。
②2HI
 H
2+I
2为反应前后气体体积不变的反应,在恒容容器中发生反应,HI的物质的量增加为原来的2倍,平衡不移动,但是反应速率加快,反应时间缩短,达到平衡时各组分浓度为原来的2倍,而体积分数不变。
H
2+I
2为反应前后气体体积不变的反应,在恒容容器中发生反应,HI的物质的量增加为原来的2倍,平衡不移动,但是反应速率加快,反应时间缩短,达到平衡时各组分浓度为原来的2倍,而体积分数不变。
(3)根据反应Zn+2H +=Zn 2 ++H 2↑可知,增大反应速率,只要增大H +浓度即可,NaHSO 3与H +反应,H +浓度减小,反应速率减小;Na 2SO 4对反应速率没影响;NaNO 3与H +结合会生成HNO 3,反应不产生H 2;只有CuSO 4合适,Zn+Cu 2 +=Cu+Zn 2+,Zn与生成的Cu形成原电池,反应速率加快。
【简答题】

[9/1055]可逆反应 【图片】 【图片】 【图片】 【图片】,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(...
参考答案:
|
B
|
参考解析:
由图像Ⅰ可知,温度为T 2时可逆反应先达到平衡状态,当其他条件不变时,温度越高,反应速率越大,达到平衡所用的时间越短,知T 2>T 1;温度越高,平衡时C的百分含量(C%)越小,说明平衡向左移动,当其他条件不变时,升高温度平衡向吸热方向移动,故反应的正反应为放热反应;由图像Ⅱ可知,当其他条件不变时,随着压强的增大,正速率大于逆反应速率,说明平衡向右移动,当其他条件不变时,增大压强,平衡向气体物质系数减小的方向移动,故正反应为气体物质的量减小的反应,即a+b>c。A、根据上述分析知,T 2>T 1,Q<0,错误;B、根据上述分析知,增大压强,平衡向右移动,物质B的转化率增大,正确;C、D为固体,反应达平衡后,增加少量的D,平衡不移动,错误;D、根据上述分析知,正反应为气体物质的量减小的反应,即a+b>c,错误。
【简答题】

[10/1055]下列说法正确的是 ( ) ①活化分子间的碰撞一定能发生化学反应 ②普通分子有时也能发生有效碰撞 ③升高温度会加快反应速率,原因是增加了活化分子的有效...
参考答案:
|
A
|
参考解析:
无