
下载APP

其他金属及化合物(锌、锰、钙、金等)题库

题数
111
考试分类
高中化学>其他金属及化合物(锌、锰、钙、金等)
售价
¥15
收藏
分享
去刷题



章节目录
简介
高中化学-其他金属及化合物(锌、锰、钙、金等)
...更多
题目预览
【简答题】

[1/111](8分)Ⅰ、钨是我国丰产元素,是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。...
参考答案:
|
(8分)
Ⅰ、(1) 六(1分) (2) B: H 2WO 4(1分) C: WO 3(1分) (3) 2 WO 3 +3C ="=2W" +3CO 2↑(1分); (4) n (W) (V): n (W) (VI) ="1:" 4(2分) 分析:把+5价钨的氧化物和+6价钨的氧化物的化学式分别写成WO 2.5和WO 3 设蓝色氧化钨的组成为x WO 2.5 ·y WO 3= WO 2.90 所以有x+ y="1 " 2.5x+ 3y=2.90 解联立方程得:x ="0.20 " y=0.80 所以蓝色氧化钨中+5价和+6价钨的原子数之比为: w (+5)/ w (+6)=" x/" y=0.20/0.80=1/4=0.25 Ⅱ、1.8克(2分) |
参考解析:
无
【简答题】

[2/111]实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg=C...
参考答案:
|
(1)+1 (2)CuI 0.5 (3)2 5 2 1 |
参考解析:
无
【简答题】

[3/111](10分) 高锰酸钾是锰的重要化合物和常用的氧化剂。工业上以软锰矿(主要成分是MnO 2)为原料制备高锰酸钾晶体。请回答下列问题: (1)通常高锰酸钾...
参考答案:
|
(10分)
(1) c (2) b(3) 2H 2O 2 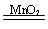 2H
2O + O
2 ↑(4) ①cd②c (5) ①d②高锰酸钾溶液的紫色褪去 2H
2O + O
2 ↑(4) ①cd②c (5) ①d②高锰酸钾溶液的紫色褪去
2KMnO 4 + 5H 2C 2O 4 + 3H 2SO 4 ="==" 2MnSO 4 + K 2SO 4 + 10CO 2↑ + 8H 2O(10分) (1) c (2) b(3) 2H 2O 2 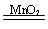 2H
2O + O
2 ↑(4) ①cd②c (5) ①d②高锰酸钾溶液的紫色褪去 2H
2O + O
2 ↑(4) ①cd②c (5) ①d②高锰酸钾溶液的紫色褪去
2KMnO 4 + 5H 2C 2O 4 + 3H 2SO 4 ="==" 2MnSO 4 + K 2SO 4 + 10CO 2↑ + 8H 2O |
参考解析:
略
【简答题】

[4/111]氯化钯是一种重要的催化剂,在石油化工和汽车尾气转化中应用广泛,从工业废料中提取钯通常得到的物料是二氯二氨合钯,然后再用复杂的工艺得到氯化钯,并且环境污...
参考答案:
|
⑴ Pd(NH
3)
2Cl
2+2HCl=(NH
4)
2[PdCl
4](2分)
⑵ 6ClO 3 -+10NH 4 +=3Cl 2+5N 2+18H 2O+4H +(2分) 钯以H 2PdCl 4形式存在(1分) ⑶ H 2PdCl 4+4NaOH=Pd(OH) 2↓+4NaCl+2H 2O(2分) 过量NaOH与部分Pd(OH) 2发生反应:Pd(OH) 2+2NaOH=Na 2[Pd(OH) 4](2分) ⑷ Pd(OH) 2+2HCl=PtCl 2+2H 2O(1分) |
参考解析:
⑴二氯二氨合钯(Ⅱ)与HCl发生配体的取代反应,生成配阴离子PtCl
4
2-,阳离子为NH
4
+。因此A为(NH
4)
2[PdCl
4],反应方程式为Pd(NH
3)
2Cl
2+2HCl=(NH
4)
2[PdCl
4]。
⑵氯酸钠的主要作用在于氧化NH 4 +生成N 2,同时ClO 3 -被还原生成Cl 2。利用离子-电子法配平该氧化还原方程式:
氧化反应:2NH 4 +-6e -→N 2+8H +
还原反应:2ClO 3 -+12H ++10e -→6H 2O+Cl 2
∴化学反应方程式为:6ClO 3 -+10NH 4 +=3Cl 2+5N 2+18H 2O+4H +
由于溶液酸性增强,所以钯此时以H 2PdCl 4形式存在。
⑶根据题意,沉淀为Pd(OH) 2。当溶液碱性增强时,OH -作为配体,进一步与Pd(Ⅱ)配位,形成四配位的Pd(OH) 4 2-,从而导致上层清液中钯含量升高。
⑷Pd(OH) 2与盐酸发生中和反应,生成产物PdCl 2。
⑵氯酸钠的主要作用在于氧化NH 4 +生成N 2,同时ClO 3 -被还原生成Cl 2。利用离子-电子法配平该氧化还原方程式:
氧化反应:2NH 4 +-6e -→N 2+8H +
还原反应:2ClO 3 -+12H ++10e -→6H 2O+Cl 2
∴化学反应方程式为:6ClO 3 -+10NH 4 +=3Cl 2+5N 2+18H 2O+4H +
由于溶液酸性增强,所以钯此时以H 2PdCl 4形式存在。
⑶根据题意,沉淀为Pd(OH) 2。当溶液碱性增强时,OH -作为配体,进一步与Pd(Ⅱ)配位,形成四配位的Pd(OH) 4 2-,从而导致上层清液中钯含量升高。
⑷Pd(OH) 2与盐酸发生中和反应,生成产物PdCl 2。
【简答题】

[5/111]在空气中能生成致密氧化膜的金属是( ) A.Al B....
参考答案:
| A |
参考解析:
无
【简答题】

[6/111]金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体): 【图片】(1)在灼烧...
参考答案:
|
(1)MoS
2(1分) 14mol(2分)
(2)坩埚(1分) (3)2NH 3·H 2o+MoO 3=2NH 4 ++ MoO 4 2-+H 2O(2分) (4)静置后,向上层清液中继续滴加硝酸,若无明显现象,则硝酸过量。(2分) (5)①无水硫酸铜(2分) ②a→c→b→d(2分) |
参考解析:
(1)
 ,MoS
2化合价升高为还原剂。1mol MoS
2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
,MoS
2化合价升高为还原剂。1mol MoS
2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
(2)步骤①中,灼烧使用的一起为坩埚。
(3)(4)见答案
(5)①该反应的氧化产物为水,用无水硫酸铜检验。
②见答案
【简答题】

[7/111]钾是活泼的碱金属,钾和氧有氧化钾(K 2O)、过氧化钾(K 2O 2)和超氧化钾(KO 2)等多种化合物。 (1)钾和硝酸钾反应可制得K 2O(10K...
参考答案:
|
(1)28.2g
(2)96.25% (3)71g (4)K xO y+x/2CO 2→x/2K 2CO 3+(y-0.5x)/02 39x+16y 11.2(y-0.5x) 6.3 1.12 解得x︰y=2︰3 即n(K)︰n(O)=2︰3 即得化学式为:(KO 2与K 2O 2 2︰1) (KO 2与K 2O 4︰1) |
参考解析:
此题考查的是化学基本计算能力。
解:(1)设10.1g硝酸钾反应需要Kxg,反应生成K 2Oyg
10K + 2KNO 3→ 6K 2O+ N 2
202 564
x 10.1 y
解得x="19.5" <39 钾过量, y=28.2
(2)设样品中含K 2O 21mol,杂质质量为a克,由题意得:
(110+a) ×0.28=110×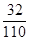
解得:a="4.29"
w(K 2O 2)="110÷(110+4.29)" ×100% =96.25%
(3)设反应消耗KO 2 z克
4KO 2+2CO 2→2K 2CO 3+3O 2 ΔV
284 44.8 67.2 22.4
z 18.8-13.2
解得:z=71
(4)K xO y+x/2CO 2→x/2K 2CO 3+(y-0.5x)/02
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO 2与K 2O 2 2︰1) (KO 2与K 2O 4︰1)
【思路点拨】(1)小题为过量计算,(2)小题为质量分数计算;(3)小题为物质的量计算和差量计算;(4)为计算推断
解:(1)设10.1g硝酸钾反应需要Kxg,反应生成K 2Oyg
10K + 2KNO 3→ 6K 2O+ N 2
202 564
x 10.1 y
解得x="19.5" <39 钾过量, y=28.2
(2)设样品中含K 2O 21mol,杂质质量为a克,由题意得:
(110+a) ×0.28=110×
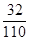
解得:a="4.29"
w(K 2O 2)="110÷(110+4.29)" ×100% =96.25%
(3)设反应消耗KO 2 z克
4KO 2+2CO 2→2K 2CO 3+3O 2 ΔV
284 44.8 67.2 22.4
z 18.8-13.2
解得:z=71
(4)K xO y+x/2CO 2→x/2K 2CO 3+(y-0.5x)/02
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO 2与K 2O 2 2︰1) (KO 2与K 2O 4︰1)
【思路点拨】(1)小题为过量计算,(2)小题为质量分数计算;(3)小题为物质的量计算和差量计算;(4)为计算推断
【简答题】

[8/111]铀(U)常见化合价有+4价和+6价,硝酸铀酰[UO 2(NO 3) 2]加热可发生如下反应:UO 2(NO 3) 2 【图片】UxOy+NO 2↑+O...
参考答案:
|
C
|
参考解析:
化合价升降法:从气体全部被水吸收可知:硝酸铀酰的分解反应中,N元素的降价与O元素的升价已相等,从而推出:U元素没变价,即仍为+6价,故选C。
【简答题】

[9/111]对下列材料的特征及用途的说法不正确的是 A.玻璃纤维柔软如丝,可像棉纱一样纺织,但拉伸强度低B.光导纤维传导光的能力很强,是非常好的通讯材料C.氮化硅...
参考答案:
|
A
|
参考解析:
无
【简答题】

[10/111](9分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和 【图片】,并含有3.5%(质量分数) 【图片】。 (1) 【图片】元素在周期表...
参考答案:
|
(1)第四周期第ⅡA族,
 (2) (2)
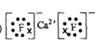
(3)2P + 5FeO + 3CaO  Ca
3(PO
4)
2+5Fe Ca
3(PO
4)
2+5Fe
(4)Fe 3+ + 3SCN -="=" Fe(SCN) 3 (5)1.1 (各2分) |
参考解析:
最活泼的非金属是F,即A的化学式为CaCl
2,含有离子键,属于离子化合物。由方程式可知P的化合价升高5个单位,铁的化合价降低2个单位,根据得失电子守恒可以配平。白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)
n,说明
 是铁离子,可用KSCN检验。1.6g钙线试样含有氧化钙
是铁离子,可用KSCN检验。1.6g钙线试样含有氧化钙
 。生成224ml.H
2(标准状况),因此金属钙的物质的量是
。生成224ml.H
2(标准状况),因此金属钙的物质的量是
 ,即最后溶液含有0.011mol钙离子,所以最终的碳酸钙沉淀是0.011mo×100g/mol=1.1g。
,即最后溶液含有0.011mol钙离子,所以最终的碳酸钙沉淀是0.011mo×100g/mol=1.1g。
 是铁离子,可用KSCN检验。1.6g钙线试样含有氧化钙
是铁离子,可用KSCN检验。1.6g钙线试样含有氧化钙
 。生成224ml.H
2(标准状况),因此金属钙的物质的量是
。生成224ml.H
2(标准状况),因此金属钙的物质的量是
 ,即最后溶液含有0.011mol钙离子,所以最终的碳酸钙沉淀是0.011mo×100g/mol=1.1g。
,即最后溶液含有0.011mol钙离子,所以最终的碳酸钙沉淀是0.011mo×100g/mol=1.1g。