
下载APP

工业生产其他物质(工业制备碳酸锂、硫酸钡等化工原理)题库

题数
174
考试分类
高中化学>工业生产其他物质(工业制备碳酸锂、硫酸钡等化工原理)
售价
¥15
收藏
分享
去刷题



章节目录
简介
高中化学-工业生产其他物质(工业制备碳酸锂、硫酸钡等化工原理)
...更多
题目预览
【简答题】

[1/174]由固体碱熔氧化法可制备重铬酸钾,已知精选后的铬铁矿主要成分是亚铬酸铁[Fe(CrO2)2或FeO·Cr2O3],还含有硅、铝的氧化物等杂质。 【图片】...
参考答案:
| (1)C;A (2)  (3)FeO2-+ 2H2O = Fe(OH)3↓ + OH- (4)Al(OH)3;H2SiO3 (5)蒸发浓缩;冷却结晶 |
参考解析:
无
【简答题】

[2/174]碳酸锂广泛应用于陶瓷和医药等领域。以 【图片】-锂辉石(主要成分为Li2O 【图片】Al2O3 【图片】4SiO2)为原材料制备Li2CO3的工艺流程...
参考答案:
| (1)加快反应速率 (2)石灰石 (3)  (4)  (5)NaOH |
参考解析:
无
【简答题】

[3/174]“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中IIIB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极...
参考答案:
| (1)B (2)Fe(OH)3;Y3++3NH3·H2O=Y(OH)3↓+3NH4+ (3)Y2(C2O4)3  Y2O3+3CO↑+3CO2↑ Y2O3+3CO↑+3CO2↑(4)分解出HCl气体,抑制CeCl3的水解(或其他合理答案) (5)2Ce3++H2O2+6H2O=2Ce(OH)4↓+6H+ |
参考解析:
无
【简答题】

[4/174]工业上用粗CuO制备CuCl2·2H2O的流程如下 【图片】 各种离子相关数据如下 【图片】 请回答:(1)CuO溶于盐酸的离子方程式是_______...
参考答案:
| (1)CuO+2H+=Cu2++H2O |
| (2)①碱;否;引入杂质(或因NaClO溶液显碱性,会将Cu2+转化成沉淀);②bc (3)c |
参考解析:
无
【简答题】

[5/174]硫酸锌可作为食品锌强化剂的原料,工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺...
参考答案:
| (1)增大反应物间的接触面积,从而增大反应速率 (2)2Fe(OH)2+ClO-+H2O=2Fe(OH)3+Cl- (3)FeO(OH) (4)8.0≤pH<10.4 (5)b;d (6)蒸发浓缩;冷却结晶 (7)  |
参考解析:
无
【简答题】

[6/174](三选一)【化学与技术】2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中。 Ⅰ:某...
参考答案:
| (1)250mL容量瓶、胶头滴管 (2)①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(只要答出任意一点即可) (3)氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离; Fe3+和Al3+ (4)Ca2+、Mg2+ (5)1, 3, 11H2O,2, 1 (6)Fe-2e-= Fe2+;2H++2e-=H2↑ |
参考解析:
无
【简答题】

[7/174]某工业生产经过以下转化步骤:下列说法中不正确的是 【图片】 [ ] A.该过程是一种新的硫酸生产方法 ...
参考答案:
| A |
参考解析:
无
【简答题】

[8/174]铁氧体可用于隐形飞机上吸收雷达波涂料。一种以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下 【图片】 (1)酸浸时,二氧化锰被双氧水还原的化学方程式为...
参考答案:
| (1)MnO2+H2O2+H2SO4 = MnSO4 +O2↑+2H2O (2)还原剂 (3)①随pH值的升高汞的去除率先降低后增加;②Mn2+具有催化作用 (4)MnO·4ZnO·5Fe2O3 (5)调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成 |
参考解析:
无
【简答题】

[9/174]以黄铁矿为原料制硫酸产生的硫酸渣中含酶Fe2O3、SiO2、Al2O3、CaO、MgO等。现用硫酸渣制备铁红的过程如下 【图片】 (1)铁红的主要成分...
参考答案:
| (1)Fe2O3;SiO2 (2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O (3)FeS2+4Fe3++8H2O=15Fe2++2SO42-+16H+ (4)4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓) (5)使Fe3+完全沉淀,而其他金属阳离子不生成沉淀 |
参考解析:
无
【简答题】

[10/174]以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略): Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。 Ⅱ.将FeSO4·7H2O配...
参考答案:
| (1)Fe+2Fe3+=3Fe2+ (2)加入硫酸,H+浓度增大,使Fe2++2H2O 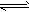 Fe(OH)2+2H+得平衡向逆反应方向移动,从而抑制 Fe(OH)2+2H+得平衡向逆反应方向移动,从而抑制FeSO4的水解 (3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;4FeCO3+6H2O+O2==4Fe(OH)3↓+4CO2↑ (4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净 (5)288.0 |
参考解析:
无