
下载APP

元素周期表题库

题数
1653
考试分类
高中化学>元素周期表
售价
¥30
收藏
分享
去刷题



章节目录
简介
高中化学-元素周期表
...更多
题目预览
【简答题】

[1/1653]据国外有关资料报道,在独居石(一种共生矿,化学成分为Ge, La, Nb,…的磷酸盐)中,查明尚有未命名的116、124、126号元素。试判断,116...
参考答案:
| B |
参考解析:
无
【简答题】

[2/1653]前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种 [ ] A.3种 B.4种 C.5...
参考答案:
| C |
参考解析:
无
【简答题】

[3/1653]现有下列短周期元素性质的数据: ① ② ③ ④ ⑤ ⑥ &nbs...
参考答案:
| ①只有-2价,处于第ⅥA族,则①为O;⑤有+7、-1价,则为Cl;③⑥最高正价为+1,处于第ⅠA族,原子半径大于其它原子,且⑥的原子半径较大,故③为Li,⑥为Na;④⑦有+5、-3价,处于ⅤA族,④的原子半径较大,故④为P、⑦为N;②最高正价为+2,处于ⅡA族,原子半径大于Li,故②为Mg;⑧最高正价为+3,处于ⅢA族,原子半径比Cl小,故⑧为B, A.④⑦有+5、-3价,处于ⅤA族,④的原子半径较大,故④为P、⑦为N,元素原子序数④号的大于⑦号,故A正确; B.②为Mg,③为Li,则②、③号元素不处于同一周期,故B错误; C.⑤为Cl,最高价氧化物的水化物为HClO4,是含氧酸中酸性最强的酸,故C正确; D.⑧为B元素,属于非金属性元素,故D错误; 故选D. |
参考解析:
无
【简答题】

[4/1653]下列叙述正确的是 [ ] A.除O族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 &...
参考答案:
| C |
参考解析:
无
【简答题】

[5/1653]A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3...
参考答案:
| (1)氮;二;第ⅤA族 (2)“略” (3)S;SO3 (4)KOH |
参考解析:
无
【简答题】

[6/1653]下列叙述正确的是( ) A.沸点:CH4<SiH4<GeH4<SnH4B.离子半径:K+>Na+>S2->F-C.非金属性:F>O>P>SD.酸性:...
参考答案:
| A、CH4、SiH4、GeH4、SnH4都可以形成分子晶体,分子结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故沸点CH4<SiH4<GeH4<SnH4,故A正确; B、Na+与F-离子,K+与S2-电子层排布相同,核电荷数越大离子半径越小,所以离子半径K+<S2-、Na+<F-,最外层电子数相同电子层越多离子半径越大,所以离子半径K+>F-,故离子半径Na+<F-<K+<S2-,故B错误; C、同周期自左而右非金属性增强,所以非金属性F>O、P<S,同主族自上而下非金属性减弱,所以非金属性O>S,所以非金属性F>O>S>P,故C错误; D、HBr是强酸,H2CO3、CH3COOH、HClO是弱酸,酸性HClO<H2CO3<CH3COOH,所以酸性HClO<H2CO3<CH3COOH<HBr,故D错误. 故选:A. |
参考解析:
无
【简答题】

[7/1653]下列化学用语错误的是( ) A.NaCl的电子式 【图片】B.甲烷的结构式 【图片】C.Mg原子结构示意图 【图片】D.乙烯的结构简式CH2=CH2
参考答案:
A.NaCl的电子式为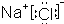 ,故A正确; ,故A正确; B.甲烷分子的结构式为 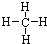 ,故B正确; ,故B正确;C.Mg原子结构示意图 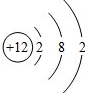 ,故C错误; ,故C错误;D.乙烯的结构简式CH2=CH2,故D正确. 故选C. |
参考解析:
无
【简答题】

[8/1653]常温下最难与氢气发生反应的是( ) A.氮气B.氯气C.氟气D.氧气
参考答案:
| 氮气分子中含有N≡N,N≡N的键能非常大,不易断裂,所以氮气非常稳定不容易发生化学反应,因此氮气与氢气反应很难进行,需要高温高压催化剂的条件; 氯气比较活泼在光照或加热条件下能与氢气反应; 氟气非常活泼黑暗处就能与氢气反应; 氧气比较活泼在加热或点燃的条件下能与氢气反应; 所以最难与氢气发生反应的是氮气,故A正确; 故选A. |
参考解析:
无
【简答题】

[9/1653]下列元素一定属于主族元素的是 [ ] A.位于元素周期...
参考答案:
| D |
参考解析:
无
【简答题】

[10/1653]右图表示碱金属的某些性质与核电荷数的变化关系,下列各性质中不符合图示关系的是( ) A.还原性B.与水反应的剧烈程度C.熔点D.原子半径 【图片】
参考答案:
| A.碱金属元素中,随着碱金属的核电核数的增大,元素的金属性逐渐增强,单质的还原性逐渐增强,故A正确; B.碱金属元素中,随着碱金属的核电核数的增大,元素的金属性逐渐增强,与水反应的剧烈程度逐渐增大,故B正确; C.碱金属元素中,随着碱金属的核电核数的增大,金属晶体的金属键作用力减弱,熔点逐渐降低,故C错误; D.碱金属元素中,随着碱金属的核电核数的增大,核外电子层数逐渐增多,电子层数越多,半径越大,故D正确. 故选C. |
参考解析:
无