
下载APP

酸碱中和滴定题库

题数
268
考试分类
高中化学>酸碱中和滴定
售价
¥20
收藏
分享
去刷题



章节目录
简介
高中化学-酸碱中和滴定
...更多
题目预览
【简答题】

[1/268]某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.实验步骤如下,回答下列问题:(1)用分析天平准确称取该样...
参考答案:
| (1)滴定时,氢氧化钠溶液使用碱式滴定管盛取,故答案为:碱式滴定管; (2)滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面, 故答案为:用待装液润洗; (3)若用测定溶液pH的方法来确定滴定的终点,pH计是用来测量溶液pH的仪器,能较方便准确地测定溶液的pH,在滴定终点附近溶液的pH会出现突变,所以此时需每滴一滴测一次 故答案为:pH计;每滴一滴测一次; (4)根据表中数据可以绘制出中和滴定的曲线为: 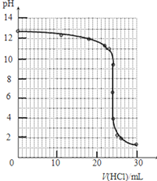 , ,故答案为:  ; ;(5)依据图象和图表数据分析可知pH突变是4.0~9.9,盐酸和氢氧化钠恰好反应生成的氯化钠溶液呈中性,甲基橙变色范围为3.1-4.4,酚酞pH变色范围为8.2~10.0,甲基橙和酚酞都可以用作指示剂;由于石蕊变色时不容易判断,一般不选作指示剂; 滴定结束前,溶液为碱性,溶液颜色为红色,滴定结束时有粉红色变成无色,所以滴定终点的现象是溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色), 故答案为:甲基橙或酚酞;溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色); (6)氢氧化钠溶液的浓度为:
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g, 故样品中,NaOH的质量百分含量为:
滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,导致消耗的标准液体积偏大,测定结果偏大, 答案为:96%;偏大. |
参考解析:
无
【简答题】

[2/268]下列实验操作正确的是( ) A.中和滴定实验时,锥形瓶用蒸馏水洗净,烘干后才能使用B.中和热的测定实验中,读取混合溶液的最高温度为终止温度C.实验室...
参考答案:
| B |
参考解析:
无
【简答题】

[3/268]用标准的盐酸滴定未知浓度的NaOH溶液时,下列各操作中,无误差的是( ) A.用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定 B.用蒸馏水洗涤锥...
参考答案:
| C |
参考解析:
无
【简答题】

[4/268]用中和滴定法测定烧碱的纯度,已知烧碱中杂质不与酸反应,试根据要求填空.(1)配置待测液:称取5.0g烧碱样品,配成250mL待测溶液;在配置过程中,所...
参考答案:
| (1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器是:250mL容量瓶、胶头滴管;故答案为:250mL容量瓶;胶头滴管; (2)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,故答案为:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色; (3)V(标准)═[(21.48-0.50)+(25.02-4.00)]mL÷2=21.00mL c(待测)=
m═CVM═0.42mol•L-1×0.25L×40g/mol=4.2g ω(烧碱)=
|
参考解析:
无
【简答题】

[5/268](1)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:酸式滴定管用...
参考答案:
(1)滴定管使用前应用盐酸润洗,故答案为:用标准盐酸润洗2-3次;中和滴定中盐酸和NaOH的物质的量相等,(V2-V1)a=c (NaOH)V,滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故答案为:用标准盐酸润洗2-3次;
(2)开始pH=1,由pH=-lgc(H+),则c(HCl)=0.1mol/L,曲线a的pH升高,且pH=1,则为NaOH滴定HCl;曲线b的pH降低,且开始pH=13,则为HCl滴定NaOH, 故答案为:NaOH;HCl;HCl;NaOH;0.1. |
参考解析:
无
【简答题】

[6/268]滴定法是化学定量分析的一种重要而普遍的方法.I:如图是常温下用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1某一元...
参考答案:
| Ⅰ:(1)配制溶液时一定用到容量瓶,实验需用约400mL,应用500mL容量瓶,故答案为:500mL容量瓶; (2)酸的浓度为0.1000 mol•L-1,由图象可以看出0.1000mol•L-1一元酸HX溶液的PH>1,当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,都可以说明HX为弱酸, 故答案为:弱酸;当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000 mol•L-1 HX的pH大于1; (3)点①所示溶液中,酸过量,溶液呈酸性,则溶液中存在c(H+)>c(OH-), 根据溶液电中性:c(H+)+c(Na+)=c(X-)+c(OH-),则c(X-)>c(Na+),且c(Na+)>c(H+), 故有c(X-)>c(Na+)>c(H+)>c(OH-), 故答案为:c(X-)>c(Na+)>c(H+)>c(OH-); Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO4溶液滴入后,溶液由无色变为红色, 故答案为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色; (2)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O, 故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O; (3)第2组数据误差较大,舍去,根据其它三组数据计算,高锰酸钾溶液的平均体积为:
5CaC2O4~5H2C2O4~2MnO4- 5mol 5mol 2mol n 0.1mol/L×9×10-3L n=2.25×10-3mol, 则m(Ca2+)=2.25×10-3mol×40g/mol=0.09g, 所以1L样品中含有0.09g×
故答案为:9.00; (4)a.滴定前俯视读数,滴定后仰视读数,会导致体积偏大,测量结果偏大,故a错误; b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外,会导致所需标准液偏小,故b正确; c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故c错误; d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体,会导致所需标准液偏小,故d正确. 故答案为:b、d. |
参考解析:
8.98+9.02+9.003
【简答题】

[7/268]在化学实验操作中,往往由于读数不规范导致较大的实验误差.下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)( ) A.配制5...
参考答案:
| C |
参考解析:
无
【简答题】

[8/268]下列有关滴定操作的顺序正确的是( )①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准...
参考答案:
| B |
参考解析:
无
【简答题】

[9/268](I)滴定分析法是化学分析法中的重要分析方法之一.(一)用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).A.实验步骤:(1)用酸式滴定管量取1...
参考答案:
| (I)(一)(3)液面读数0.70mL,故答案为:0.70mL; (4)滴定终点时,溶液由无色恰好变为红色,且半分钟内不褪色,停止滴定,故答案为:溶液由无色恰好变为红色,且半分钟内不褪色; C.(1)C.(1)先根据数据的有效性,舍去第1组数据,然后求出2、3、4三组平均消耗V(NaOH)=15.00mL, CH3COOH+NaOH=CH3COONa+H2O 0.0015mol 0.015L×0.1000mol/L 则20.00mL样品中含有的醋酸的质量为0.0015mol×60g/mol=0.9g,市售白醋总酸量4.5g/100mL; (2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,会使得标准NaOH溶液浓度减小,造成V(标准)偏大,根据c(待测)=
b.碱式滴定管的尖嘴在滴定前无气泡,滴定后有气泡,造成V(标准)偏小,根据c(待测)=
c.锥形瓶中加入待测白醋溶液后,再加少量水,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量减小,造成V(标准)减小,根据c(待测)=
故选:a; (二)(1)①A处在碱性条件下变色,所以选用酚酞,故答案为:酚酞; ②溶液中含有H2CO3,加热或振荡加快H2CO3的分解,除去溶液中过多的CO2;故答案为:加快H2CO3的分解,除去溶液中过多的CO2; (II)(2)实验二:Al2O3能加快H2O2溶液的分解速率;故答案为:Al2O3能加快H2O2溶液的分解速率; (4)上述反应前后Al2O3质量和化学性质是否改变,故答案为:上述反应前后Al2O3质量和化学性质是否改变; (5)阴离子也能影响化学反应速率,所以控制阴离子相同,排除阴离子的干扰,将FeCl3改为Fe2(SO4)3,故答案为:控制阴离子相同,排除阴离子的干扰;将FeCl3改为Fe2(SO4)3. |
参考解析:
c(标准)×V(标准)V(待测)
【简答题】

[10/268]下列是关于盐酸滴定氢氧化钠溶液的实验叙述:①取一锥形瓶用待测NaOH溶液润洗两次;②在锥形瓶中放入25.00mL待测液;③加入几滴石蕊试剂滴至刚变紫色...
参考答案:
| D |
参考解析:
无