
下载APP

物质性质的研究题库

题数
949
考试分类
高中化学>物质性质的研究
售价
¥25
收藏
分享
去刷题



章节目录
简介
高中化学-物质性质的研究
...更多
题目预览
【简答题】

[1/949]X、Y、Z是3种短周期元素,原子序数依次增大.其中X、Y位于同一周期,Y、Z位于同一主族.Y原子的最外层电子数是其电子层数的3倍.X、Y原子序数相差2...
参考答案:
| X、Y、Z是3种短周期元素,原子序数小于19;三种元素的原子序数依次增大,Y原子的最外层电子数是其电子层数的3倍,最外层电子数不大于8,所以Y是O元素;Y、Z位于同一主族,且Z的原子序数小于19,所以Z是S元素;X、Y原子序数相差2,X、Y位于同一周期,且X的原子序数小于Y的原子序数,所以X是C元素,即X是C元素,Y是O元素,Z是S元素. A、XY2是CO2,二氧化碳是直线型分子,故A正确; B、Z是S元素,属于第ⅥA族,其最高化合价是+6价,所以Z元素最高价氧化物对应水化物的化学式可表示为H2ZO4,故B正确; C、氢化物的稳定性与非金属元素的非金属性有关,非金属性越强其氢化物越稳定,C、O、S三种非金属性强弱关系为O>S>C,所以Y的氢化物最稳定,故C正确; D、同一周期中元素的原子半径随着原子序数的增大而减小,同一主族中,元素的原子半径随着原子序数的增大而增大,所以C、O、S三种元素的半径由大到小的顺序为Z>X>Y,故D错误; 故选D. |
参考解析:
无
【简答题】

[2/949]下列有关物质的性质或应用的说法不正确的是( ) A.二氧化硅是生产光纤制品的基本原料B.水玻璃可用于生产黏合剂和防火剂C.盐析可提纯蛋白质并保持其生...
参考答案:
| A、二氧化硅的重要用途是生产光纤制品,故A正确; B、水玻璃即为硅酸钠水溶液具有黏性,工业上可以用于生产黏合剂,硅酸钠溶液涂刷或浸入木材后,能渗入缝隙和孔隙中,固化的硅凝胶能堵塞毛细孔通道,提高材料的密度和强度,且硅凝胶具有很强的耐高温性质,因此可以有效的防火,故B正确; C、盐析是提纯蛋白质的一种方法,而且不会影响蛋白质的生理活性,故C正确; D、石油分馏得到的是不同沸点的烃类化合物,如汽油、煤油、柴油等,只有通过裂解的方法可得到乙烯等不饱和的烃类物质,故D错误. 故选D. |
参考解析:
无
【简答题】

[3/949]某有机物A由C、H、O三种元素组成,相对分子质量为90.将9.0g A 完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4...
参考答案:
| C |
参考解析:
无
【简答题】

[4/949]SiCl 4的分子结构与CCl 4类似,对其作出如下推断,其中正确的是 ①SiCl 4晶体是分子晶体 ②常温、常压SiCl 4是液体 ③SiCl 4的...
参考答案:
|
D
|
参考解析:
正确答案:D
①SiCl 4晶体与CCl 4晶体相似,是分子晶体 ②常温、常压SiCl 4沸点高于CCl 4,是液体 ③SiCl 4的分子是由极性键Si―Cl 形成的非极性分子 ④SiCl 4相对分子质量大于CCl 4,熔点高于CCl 4
故全部正确。
【简答题】

[5/949]右表是元素周期表中短周期的一部分,已知A元素的原子中最外层电子数是其电子层数的3倍.下列关于表中六祌元素的说法不正确的是( ) A.X元素形成的气态...
参考答案:
| A元素的原子中最外层电子数是其电子层数的3倍,则A为氧元素,由元素在周期表中的相对位置可知,Z为硫元素,X为氮元素,Y为磷元素,M为氟元素,N为氯元素. A、X为氮元素,形成的氢化物为NH3,空间结构呈三角锥形,故A正确; B、X为氮元素,Y为磷元素,Z为硫元素,Y、Z形成的单核阴离子核外电子层结构相同,核电荷数越大,离子半径越小,故离子半径Y>Z,X形成的单核阴离子少1个电子层,最外层电子数相同,所以离子半径Z>X,所以离子半径中Y最大,故B正确; C、X为氮元素,形成的氢化物为NH3,氮元素的电负性较强,分子之间存在氢键,熔沸点较高,故C正确; D、M为氟元素,没有正化合价,最高价氧化物对应的水化物酸性最强的元素是氯元素,故D错误. 故选D. |
参考解析:
无
【简答题】

[6/949]PCl 3的结构类似于NH 3,是一种三角锥形分子,下列有关叙述正确的是 A.PCl3分子中三个P-Cl键的键长、键能、键角都相等B.PCl3分子中P...
参考答案:
|
A
|
参考解析:
由VSEPR理论可知,PCl
3分子中的P原子的价层电子对数为5,采取sp
3杂化,其中三个用于形成P-Cl键,另一个含有一对孤电子,故它是由三个极性P—Cl键形成的极性分子,其中的三个极性键完全相同。答案为A
【简答题】

[7/949]与主族元素在元素周期表中所处的位置有关的是( ) A.相对原子质量B.核内中子数C.次外层电子数D.电子层数和最外层电子数
参考答案:
| 元素核外电子层数等于周期表的周期数,元素的最外层电子数等于主族元素的序数,原子的核外电子排布决定元素在周期表中的位置. 故选D. |
参考解析:
无
【简答题】

[8/949]已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、...
参考答案:
| Z原子最外层电子数是次外层电子数的3倍,核外各层电子数目分别为2、6,应为O元素,Y的氢化物分子中有3个共价键,说明最外层电子数为5,且Y、Z为同周期的相邻元素,则Y为N元素,W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,应为Na元素,所以X应为H元素,则 (1)X为H元素,Y为N元素,故答案为:H;N; (2)W为Na元素,原子核外有3个电子层,最外层电子数为1,则应位于第三周期ⅠA族,Z为O元素,原子核外有2个电子层,最外层电子数为6,则原子结构示意图为 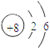 , 故答案为:第三周期IA族; 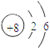 ; (3)常见由X、Y、Z所形成的离子化合物为NH4NO3,与NaOH溶液反应生成NH3•H2O,反应的离子方程式为NH4-+OH-=NH3•H2O, 故答案为:NH4NO3;NH4-+OH-=NH3•H2O; (4)NH3为共价化合物,用电子式表示的形成过程为 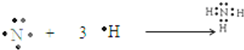 , 故答案为: 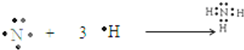 . |
参考解析:
无
【简答题】

[9/949]短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,...
参考答案:
(1)短周期A、B、C、D 4种元素,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素,C为Na元素,有A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素,D的L层电子数等于K、M两个电子层上电子数之和,则D的核外电子排布为2、8、6,应为S元素,S的质子数和中子数相等,则质量数为32,原子符号为
故答案为:C;O;Na;
(2)A、B两元素形成的AB2为CO2,为共价化合物,用电子式表示的形成过程为  , C、D两元素形成的化合物为Na2S,为离子化合物,用电子表示的形成过程为  , 故答案为:  ;  . |
参考解析:
3216
【简答题】

[10/949]物质的结构是决定物质性质的重要因素。请回答下列问题: (1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相...
参考答案:
|
(8分)(1)1s
22s
22p
63s
23p
63d
84s
2(2分);C(碳)(2分) (2)>(1分) 6(1分)(3)3(2分)
|
参考解析:
(1)Ni的原子序数为28,根据构造原理和能量最低原理可写出电子排布式为1s 22s 22p 63s 23p 63d 84s 2。第二周期有2个未成对电子的元素是C和O元素,非金属性越强,电负性越大。碳元素的非金属性弱于氧元素,因此电负性较小的是C元素。
(2)Ni 2+和Fe 2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO。NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6。
(3)单键都是
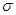 键,双键都是由1个
键,双键都是由1个
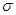 键和1个
键和1个
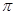 键构成的,而三键是由1个
键构成的,而三键是由1个
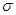 键和2个
键和2个
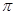 键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol
键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol
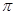 键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的
键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的
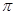 键有1.5mol×3=3mol。
键有1.5mol×3=3mol。