
下载APP

氧化还原反应的配平题库

题数
941
考试分类
高中化学>氧化还原反应的配平
售价
¥25
收藏
分享
去刷题



章节目录
简介
高中化学-氧化还原反应的配平
...更多
题目预览
【简答题】

[1/941](12分)工业以CH 3OH与NaClO 3为原料在酸性条件下制取ClO 2,同时产生CO 2气体,已知该反应分为两步进行,第一步为2ClO 3- +...
参考答案:
|
(1)CH
3OH + 3Cl
2 + H
2O = 6Cl
- + CO
2 + 6H
+ (2分)
(2)催化剂(2分) (3)1︰6.1(8分) |
参考解析:
无
【简答题】

[2/941]常温常压下等体积的H 2S和O 2充入一密闭容器中,充分混合点燃,则氧化剂与还原剂的物质的量之比为……( ) A.1:1 B.3:2 C.1:2 D....
参考答案:
|
A
|
参考解析:
无
【简答题】

[3/941]将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO 2)的混合物共0.8 mol,这些气体恰好能被500 m...
参考答案:
|
A
|
参考解析:
纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO 3) 2,每个Cu升2价,失2个电子;另一个是HNO 3到NaNO 2,每个N降2价,得2个电子。51.2gCu共失电子
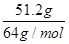 ×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO
3到NaNO
2得到的电子,所以溶液中n(NaNO
2)=
×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO
3到NaNO
2得到的电子,所以溶液中n(NaNO
2)=
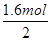 =0.8mol。气体与氢氧化钠反应的盐溶液为NaNO
3、NaNO
2混合溶液,根据钠离子守恒有n(NaNO
3)+n(NaNO
2)=n(Na
+),所以溶液中n(NaNO
3)=n(Na
+)-n(NaNO
2)=0.5L×2mol/L-0.8mol=0.2mol。选择A选项。
=0.8mol。气体与氢氧化钠反应的盐溶液为NaNO
3、NaNO
2混合溶液,根据钠离子守恒有n(NaNO
3)+n(NaNO
2)=n(Na
+),所以溶液中n(NaNO
3)=n(Na
+)-n(NaNO
2)=0.5L×2mol/L-0.8mol=0.2mol。选择A选项。
【简答题】

[4/941](8分)⑴1mol H 2SO 4中含______mol个氧原子, ...
参考答案:
|
⑴ 4mol 2NA 或1.204×10
24 ⑵ 19.6g 1:4
|
参考解析:
略
【简答题】

[5/941]许多硫的含氧酸盐在医药、化工等方面有着重要的用途。 (1)重晶石(BaSO 4)常做胃肠道造影剂。 已知:常温下,K sp(BaSO 4)=1.1×1...
参考答案:
|
(1)2.2×10
-8mol/L
(2)①取少量晶体,加水溶解,再加入足量NaOH浓溶液加热,生成能使湿润的红色石蕊试纸变蓝的气体,则有NH 4 + ②a>c>d>b (3)①5S 2O 8 2-+2Mn 2 ++8H 2O  10SO
4
2-+2MnO
4
-+16H
+ 10SO
4
2-+2MnO
4
-+16H
+
②2SO 4 2--2e -=S 2O 8 2-(或2HSO 4 --2e -=S 2O 8 2-+2H +) 增大 ③淀粉 
×100%=94.50% |
参考解析:
(1)K
sp=c(Ba
2
+)·c(SO
4
2-),所以c(Ba
2
+)=
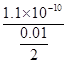 mol/L=2.2×10
-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH
4
+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO
4
-;②阳极失电子化合价升高:2SO
4
2--2e
-=S
2O
8
2-,阴极H
+放电,水的电离平衡正向移动,c(OH
-)增大;③K
2S
2O
8具有强氧化性可以将I
-氧化为I
2,所以指示剂选择淀粉,由S
2O
8
2-+2I
-=2SO
4
2-+I
2和I
2+2S
2O
3
2-=2I
-+S
4O
6
2-,得关系n(S
2O
8
2-)~2n(S
2O
3
2-)。
mol/L=2.2×10
-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH
4
+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO
4
-;②阳极失电子化合价升高:2SO
4
2--2e
-=S
2O
8
2-,阴极H
+放电,水的电离平衡正向移动,c(OH
-)增大;③K
2S
2O
8具有强氧化性可以将I
-氧化为I
2,所以指示剂选择淀粉,由S
2O
8
2-+2I
-=2SO
4
2-+I
2和I
2+2S
2O
3
2-=2I
-+S
4O
6
2-,得关系n(S
2O
8
2-)~2n(S
2O
3
2-)。
点拨:本题考查离子反应,考查考生综合分析问题的能力。难度中等。
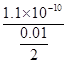 mol/L=2.2×10
-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH
4
+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO
4
-;②阳极失电子化合价升高:2SO
4
2--2e
-=S
2O
8
2-,阴极H
+放电,水的电离平衡正向移动,c(OH
-)增大;③K
2S
2O
8具有强氧化性可以将I
-氧化为I
2,所以指示剂选择淀粉,由S
2O
8
2-+2I
-=2SO
4
2-+I
2和I
2+2S
2O
3
2-=2I
-+S
4O
6
2-,得关系n(S
2O
8
2-)~2n(S
2O
3
2-)。
mol/L=2.2×10
-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH
4
+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO
4
-;②阳极失电子化合价升高:2SO
4
2--2e
-=S
2O
8
2-,阴极H
+放电,水的电离平衡正向移动,c(OH
-)增大;③K
2S
2O
8具有强氧化性可以将I
-氧化为I
2,所以指示剂选择淀粉,由S
2O
8
2-+2I
-=2SO
4
2-+I
2和I
2+2S
2O
3
2-=2I
-+S
4O
6
2-,得关系n(S
2O
8
2-)~2n(S
2O
3
2-)。
点拨:本题考查离子反应,考查考生综合分析问题的能力。难度中等。
【简答题】

[6/941]现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时...
参考答案:
|
A
|
参考解析:
本题涉及的反应有Al+4HNO
3(稀)=Al(NO
3)
3+NO↑+2H
2O;3Mg+8HNO
3(稀)=3Mg(NO
3)
2+2NO↑+4H
2O;Al(NO
3)
3+3NaOH=Al(OH)
3↓+3NaNO
3;Mg(NO
3)
2+2NaOH=Mg(OH)
2↓+2NaNO
3。当合金恰好溶解时,溶液中的NO
3
—与Na
+的物质的量相等,n(NO
3
—)=n(NaOH)=
 mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子数n(e
-)=n(OH
-)=
mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子数n(e
-)=n(OH
-)=
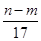 mol,故①、③正确。根据电子得失守恒知,标准状况下V(NO)=
mol,故①、③正确。根据电子得失守恒知,标准状况下V(NO)=
 L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
 mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
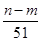 mol,所以,与合金反应的硝酸的物质的量为(
mol,所以,与合金反应的硝酸的物质的量为(
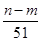 +
+
 )mol,故⑤正确。
)mol,故⑤正确。
 mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子数n(e
-)=n(OH
-)=
mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子数n(e
-)=n(OH
-)=
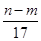 mol,故①、③正确。根据电子得失守恒知,标准状况下V(NO)=
mol,故①、③正确。根据电子得失守恒知,标准状况下V(NO)=
 L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
 mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
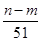 mol,所以,与合金反应的硝酸的物质的量为(
mol,所以,与合金反应的硝酸的物质的量为(
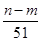 +
+
 )mol,故⑤正确。
)mol,故⑤正确。
【简答题】

[7/941]我国目前使用碘酸钾作为食用盐中碘强化剂.并规定,食用盐碘含量的平均水平(以碘元素计)为20mg/kg~30mg/kg.(1)碘酸钾与碘化钾在酸性条件下...
参考答案:
(1)该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平.故答案为: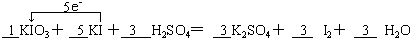 ; (2)①I2+2S2O32-=2I-+S4O62-,碘遇淀粉变蓝色,溶液中没有碘,溶液为无色,故答案为:溶液由蓝色恰好变为无色; ②I2+2S2O32-=2I-+S4O62-, 1mol 2 mol 1.0×10-5mol 2.0×10-3mol?L-1×0.01L 故答案为:1.0×10-5; ③KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O 碘酸钾中的碘 127g 3mol
设每千克食盐中含碘xmg,列比例式为
x=21,故答案为:21. |
参考解析:
无
【简答题】

[8/941]R 2O 6n—在一定条件下可以把Mn 2+氧化成MnO 4—,若反应后R 2O 6n—转变为RO 3n—。又知反应中氧化剂与还原剂的物质的量之比为5...
参考答案:
|
B
|
参考解析:
无
【简答题】

[9/941]下列叙述正确的是 A.浓硫酸可干燥H2、SO2、NH3等气体B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生C.因海水中含有镁元素,故不需经过化...
参考答案:
|
B
|
参考解析:
无
【简答题】

[10/941]已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化: Fe 3+→Fe 2+;MnO 4-→Mn 2+ ;IO 3-→ 【图片】I 2;HNO 3...
参考答案:
|
C
|
参考解析:
1mol氧化剂所得到的电子越多,生成的单质碘就越多。根据化合价的变化可知,ABCD中分别得到电子是(mol)1、5、5、1。由于IO
3
-的还原产物也是单质碘,所以选项C生成的最多,答案选C。